
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства. Химические свойства алкенов определяются наличием в их молекулах двойной связи
|
|
|
|
Химические свойства алкенов определяются наличием в их молекулах двойной связи. Электронная плотность π-связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения, обозначаемому символом АЕ (от англ. addition electrophilic). Реакции электрофильного присоединения – это ионные процессы, протекающие в несколько стадий.
На первой стадии электрофильная частица (чаще всего это бывает протон Н+) взаимодействует с π-электронами двойной связи и образует π-комплекс, который затем превращается в карбокатион путем образования ковалентной σ -связи между электрофильной частицей и одним из атомов углерода:

На второй стадии карбокатион реагирует с анионом X, образуя вторую σ -связь за счет электронной пары аниона:
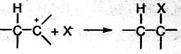
Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. Распределение зарядов определяется смещением л- электронной плотности под влиянием заместителей:

Электронодонорные заместители, проявляющие + I -эффект, смещают π-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд.
Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ (X = Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
Рассмотрим конкретные примеры реакций присоединения.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr ) образуются алкилгалогениды:

Продукты реакции определяются правилом Марковникова.
Следует, однако, подчеркнуть, что в присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
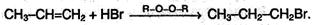
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:

3) Галогенирование. Алкены обесцвечивают бромную воду:

Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит в присутствии металлических катализаторов:
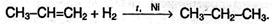
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АЕ:
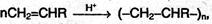
Где R = Н, СН3, Cl, С6Н5 и т.д. Молекула CH2=CHR называется мономером, полученное соединение – полимером, число п – степень полимеризации.
Полимеризация различных производных алкенов дает ценные промышленные продукты: полиэтилен, полипропилен, поливинилхлорид и другие.
Кроме присоединения, для алкенов характерны также реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:

В результате протекания этой реакции фиолетовый раствор перманганата калия быстро обесцвечивается и выпадает коричневый осадок оксида марганца (IV). Эта реакция, как и реакция обесцвечивания бромной воды, является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:

По продуктам окисления можно установить положение двойной связи в исходном алкене.
Как и все другие углеводороды, алкены горят, и при обильном доступе воздуха образуют диоксид углерода и воду:
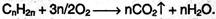
При ограниченном доступе воздуха горение алкенов может приводить к образованию монооксида углерода и воды:
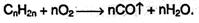
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например:

При любых температурах алкены окисляются озоном (озон более сильный окислитель, чем кислород). Если газообразный озон пропускают через раствор какого-либо алкена в тетрахлорметане при температурах ниже комнатной, то происходит реакция присоединения и образуются соответствующие озониды (циклические перекиси). Озониды очень неустойчивы и могут легко взрываться. Поэтому обычно их не выделяют, а сразу после получения разлагают водой – при этом образуются карбонильные соединения (альдегиды или кетоны), строение которых указывает на строение подвергавшегося озонированию алкена.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 397; Нарушение авторских прав?; Мы поможем в написании вашей работы!