
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Элементарные полупроводники
|
|
|
|
Полупроводниковые материалы
Полупроводниковые материалы - вещества с четко выраженными свойствами полупроводников в широком интервале температур, включая комнатную (~ 300 К), являющиеся основой для создания полупроводниковых приборов.
Для полупроводниковых материалов характерна высокая чувствительность электрофизических свойств к внешним воздействиям (нагрев, облучение, деформации и т.п.), а также к содержанию структурных дефектов и примесей.
Это используется для создания различных типов пп приборов.
Пример: удельная электрическая проводимость а при 300о К составляет 104 ~ 1010 Ом-1·см-1 и увеличивается с ростом температуры.
Полупроводниковые материалы по структуре делятся на кристаллические, твердые аморфные и жидкие.
Наибольшее практическое применение находят неорганические кристаллические полупроводниковые материалы, которые по химическому составу разделяются на следующие основные группы.
В группу элементарных полупроводников входят 12 химических элементов, которые образуют компактную группу, расположенную в середине таблицы Д. И. Менделеева (рис.2.2).
Ge, Si, C - углерод (алмаз и графит), В, a-Sn (серое олово), Те, Se и другие.
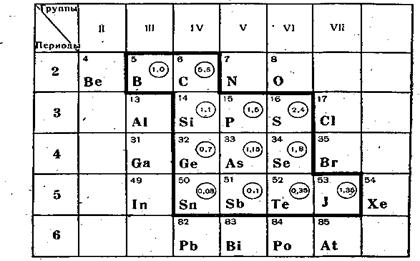
Рис.2.3 Цифры в кружке справа от символа химического элемента обозначают ширину запрещенной зоны в кристалле данного химического элемента.
Важнейшие представители этой группы - Ge и Si имеют кристаллическую решетку типа алмаза (алмазоподобны) и образуют между собой непрерывный ряд твердых растворов
2) Полупроводники АIVВIV
Карбид кремния SiC -единств. пп., образуеый элементами IV группы. Структурные модификации: b-SiC (структура сфалерита); a-SiC (гексаген. структура), и пр. Тугоплавкий и широкозонный пп.
3) Полупроводники AIVBVl,
Соединения типа AIVBVl элементов IV и VI групп периодической системы с кристаллической структурой типа NaCl также обладают полупроводниковыми свойствами. Важнейшие представители - полупроводники PbS, PbSe, PbTe, SnTe, твердые растворы, наиболее известны Pb Sn1- x Te, Pb x Sn1- x Se.
4) Полупроводники AIIIBV
Соединения типа AIIIBV элементов III и V групп периодической системы. Имеют в основном кристаллическую структуру типа сфалерита. Связь атомов в кристаллической решетке носит преимущественно ковалентный характер с некоторой долей (до 15%) ионной составляющей.
Важнейшие представители этой группы: GaAs, InP, InAs, InSb.
Многие полупроводниковые материалы типа АIIIВV образуют между собой непрерывный ряд твердых растворов -- тройных и более сложных (Ga x Al1- x As, GaAs x P1- x , Ga x In1_ x P, Ga x In1- x As y P1- y и т.п.), также являющихся важными.
5) Полупроводники AIIBVI
Соединения типа AIIBVI с кристаллич. структурой типа сфалерита или вюрцита. Связь между атомами в решетке носит ковалентно-ионный характер (доля ионной составляющей достигает 45-60%).
Важнейшие представители этой группы полупроводниковых материалов- CdTe, CdS, ZnTe, ZnSe (Селенид цинка), ZnO, ZnS.
Многие соед. типа AIIBVI образуют между собой непрерывный ряд твердых р-ров, характерными представителями к-рых являются CdxHg1-xTe, CdxHg1-xSe, CdTexSe1-x.
Физ. св-ва соед. типа AIIBV1 в значительной мере определяются содержанием собственных точечных дефектов структуры, имеющих низкую энергию ионизации и проявляющих высокую электрическую активность.
***************
Si - Silicon
Ge – Germanium,
C – Carbon, Diamond (алмаз)
GaP - Gallium Phosphide GaAs - Gallium Arsenide GaSb - Gallium Antimonide
InSb - Indium Antimonide InP - Indium Phosphide InAs - Indium Arsenide
GaN - Gallium Nitride AlN - Aluminium Nitride
GaAs1-xSbx - Gallium Arsenide Antimonide AlxGa1-xAs - Aluminium Gallium Arsenide
GaxIn1-xP - Gallium Indium Phosphide
GaxIn1-xAs - Gallium Indium Arsenide
GaxIn1-xSb - Gallium Indium Antimonide
InAs1-xSbx - Indium Arsenide Antimonide
GaxIn1-xAsyP1-y - Gallium Indium Arsenide Phosphide
GaxIn1-xAsySb1-y - Gallium Indium Arsenide Antimonide
Электронно-дырочная проводимость п/п
Основную роль в процессе объединения атомов в кристалл играют электроны внешних оболочек, так называемые валентные электроны.
Различают ионную, металлическую и ковалентную связи.
- при ионной связи валентные электроны перемещаются от одних атомов к другим. Как следствие, в структуре возникают ионы.
- при металлической связи кристаллическая решетка из положительно заряженных ионов окружена ²электронным газом².
- при ковалентной связи валентные электроны становятся общими для ближайших соседних атомов и начинают вращаться по новым молекулярным орбитам в виде электронных пар.(рис.2.3)
Твердые тела IV группы имеют ковалентную связь.
Кремний, германий и углерод (алмаз), являются элементами 4-ой группы периодической системы Менделеева.
Известно, что количество электронов на орбите равно 2n2.
У германия (14), т.о., 2, 8, 4 - не заполнено. У кремния (32), т.о., 2, 8, 18, 4 - не заполнено.
Это означает, что 4 электрона каждого атома являются валентными и участвуют в химических реакциях и процессах электропроводности.
Электроны, образующие ковалентную связь, находятся на связывающих орбитах, охватывающих по два атома, и, следовательно, каждый электрон принадлежит обоим атомам.
Ковалентные кристаллы высокой чистоты имеют очень высокое электрическое сопротивление и ведут себя подобно диэлектрику (для кремния это наблюдается при температурах, близких 0о К).
Энергия, необходимая для разрыва одной связи в атоме Si, составляет примерно 1,12 эВ,
Ge- составляет примерно 0,67 Эв, см. ПРИЛОЖЕНИЕ 1
Большинство полупроводников и металлов обладают кристаллической структурой. Кристаллическое твердое тело отличается от других атомных структур трехмерной периодичностью расположения своих атомов.
Кремний и германий имеют кристаллическую структуру в виде объемно-центрированного тетраэдра, в котором каждый атом связан с 4-мя соседними атомами ковалентными связями.
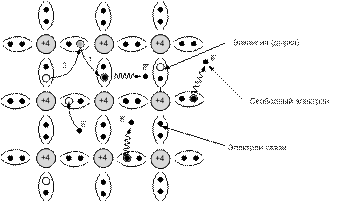
Рис. 2.4. двумерная модель кристалла (4-х валентного) с ковалентными связями
Двойные линии (рис. 2.4) символизируют два валентных электрона, вращающихся вокруг соответствующей пары атомов и образующих ковалентную связь.
При ковалентной связи (двухэлектронной) электроны связи принадлежат уже не одному, а сразу обоим связанным собой атомам, т.е. являются для них общими.
При комнатной температуре или выше, тепловой энергии колебаний решетки может быть достаточно для разрыва ковалентной связи (т.е. при поглощении фонона), (связь также может разорваться при поглощении фотона соответствующей энергии) и высвобождению валентного электрона.
Освобождение какого-либо валентного электрона из атома кремния приводит к тому, что в системе ковалентных связей возникает пустое место (вакансия, дырка).
!!!Место отсутствия электрона в решетке называют дыркой.
Высвобожденный электрон может перемещаться по кристаллической решетке, создавая ток проводимости. Этот электрон может присоединяться к валентным электронам соседнего атома; в результате местоположение отсутствующего электрона (дырка) перемещается в пространстве от одного атома к другому. Таким образом, вакансия (дырка) в электронной оболочке может создавать ток за счет того, что она перемещается от атома к атома без какого-либо притока внешней энергии, расходуемой на разрыв связей.
!!! Перемещение высвобожденного электрона по кристаллической решетке п/п сопровождается перемещением соответствующей вакансии.
Дырку можно рассматривать как некоторую частицу, аналогичную электрону (точнее, квазичастицу), но с зарядом противоположного знака.
Заряд дырки положительный, вследствие чего она, будучи помещена во внешнее электрическое поле, движется в сторону, противоположную направлению движения электрона.
!!! Электрический ток в кремнии (и любом другом полупроводнике) одновременно создается движением электронов и дырок.
Электроны и дырки, обозначаемые буквой n (negative) и p (positive) соответственно, мы будем называть также термином “носители заряда ”.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3297; Нарушение авторских прав?; Мы поможем в написании вашей работы!