
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ № 3
|
|
|
|
ТЕМА: ИДЕАЛЬНЫЙ ГАЗ. ОСНОВНЫЕ ГАЗОВЫЕ ЗАКОНЫ.
Под идеальным газом понимают воображаемый газ, в котором отсутствуют силы притяжения между молекулами, а собственный объем молекул исчезающе мал по сравнению с объемом междумолекулярного пространства. Таким образом, молекулы идеального газа принимают за материальные точки. В действительно существующих газах при высоких температурах и малых давлениях можно пренебречь силами притяжения и объемом самих молекул. Поэтому такие газы можно также считать идеальными.
В тех газах, которые находятся в состояниях, достаточно близких к сжижению, нельзя пренебречь силами притяжения между молекулами и объемом последних. Такие газы нельзя отнести к идеальным, и их называют реальными газами.
Основное уравнение кинетической теории газов имеет вид
р=2/3n· (mω2 /2) (1)
где р — давление идеального газа;
п — число молекул в 1 м3 газа (концентрация молекул);
m — масса одной молекулы;
ω — средняя квадратичная скорость поступательного движения молекул;
mω2 /2— средняя кинетическая энергия поступательного движения одной молекулы.
Таким образом, основное уравнение кинетической теории газов устанавливает связь между давлением газа, средней кинетической энергией поступательного движения молекул и их концентрацией.
Основные элементы кинетической теории материи были разработаны М. В. Ломоносовым и блестяще им применены в целом ряде химических и физических исследований, связанных с тепловыми явлениями.
Основные газовые законы.
1. Закон Бойля – Мариотта устанавливает зависимость между удельным объемом и абсолютным давлением идеального газа в процессе при постоянной температуре. Этот закон был открыт опытным путем англ. физиком Бойлем в 1664 г., и франц. химиком Мариоттом в 1676 г.
«При постоянной температуре объем, занимаемый идеальным газом, изменяется обратно пропорционально его давлению»
или «При постоянной температуре произведение удельного объема на давление есть величина постоянная». p · v = const.  (Т = const) (2)
(Т = const) (2)
2. Закон Гей-Люссака устанавливает зависимость между удельным объемом и абсолютной температурой при постоянном давлении. Этот закон был открыт экспериментальным путем франц. Физиком Жозефом Луи Гей-Люссаком в 1802 г.
«При постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам» 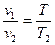 при (р=const).
при (р=const).
«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры»
 , при р=const, ρ · Т = const (3)
, при р=const, ρ · Т = const (3)
где V0 – объем газа при температуре 0º С,
V – объем газа при температуре t º С,
α- температурный коэффициент объемного расширения газа, α=1/273 К-1
3. Закон Шарля устанавливает зависимость давления газа от его температуры при постоянном удельном объеме (француз, 1737 г.).
«При постоянном объеме давление газа изменяется прямо пропорционально его абсолютной температуре» р / Т = const,  , при v = const (4)
, при v = const (4)
Для газов, взятых при одинаковых температурах и давлениях, имеет место следующая зависимость, полученная на основе закона Авогадро:
μ/ρ = const. (5)
где μ- молекулярная масса газа.
Закон Авогадро: «При одинаковых температурах и давлениях в равных объемах различных идеальных газов содержится одинаковое количество молекул».
Так как ρ=1/ v, то μ · v = const. (6)
Величина μ v представляет собой объем килограмм-молекулы или киломоля (кмоль) газа.
Так как в 1 м3 газа могут содержаться, в зависимости от параметров его состояния, разные количества газа, принято относить 1 м3 газа к так называемым нормальным условиям, при которых рабочее вещество находится под давлением р = 101 325 Па и Т = 273,15 К (760 мм рт. ст. и 0° С).
Объем 1 кмоля всех идеальных газов равен 22,4136 м3/кмоль при нормальных условиях.
Плотность газа при нормальных условиях определяется из равенства
ρн = μ/ 22,4 кг/м3 (7)
Пользуясь этой формулой, можно найти удельный объем любого газа при нормальных условиях:
v н= 22,4 / μ, м3/кг (8)
Характеристическое уравнение идеального газа или уравнение состояния было выведено франц. Физиком Клапейроном в 1834 г. и связывает между собой основные параметры состояния — давление, объем и температуру:
р · V=M · R · T; (9)
p · v = R · T; (10)
p · V μ = μ R · T, (11)
где р — давление газа в Па;
V — объем газа в м3; v —удельный объем газа в м3/кг;
М — масса газа в кг;
V μ— объем 1 кмоля газа в м3/кмоль;
R — газовая постоянная для 1 кг газа в Дж/(кг • К);
μ R — универсальная газовая постоянная 1 кмоля газа в Дж/(кмоль•К).
Каждое из этих уравнений отличается от другого лишь тем, что относится к различным массам газа: первое — к М кг; второе—к 1 кг, третье— 1 кмолю газа.
Численное значение универсальной газовой постоянной легко получить из уравнения (11) при подстановке значений входящих в него величин при нормальных условиях:
μ R= Дж/(кмоль• К) (12)
Дж/(кмоль• К) (12)
Газовую постоянную, отнесенную к 1 кг газа, определяют из уравнения
R = , Дж/(кг • К) (13)
, Дж/(кг • К) (13)
где μ — масса 1 кмоля газа в кг (численно равная молекулярной массе газа).
Газовая постоянная R – работа в джоулях 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1°.
Универсальная газовая постоянная μ R (Rμ) - работа 1 моль идеального газа в процессе при постоянном давлении и изменении температуры на 1°.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 309; Нарушение авторских прав?; Мы поможем в написании вашей работы!