
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЛЕКЦИЯ № 5
|
|
|
|
ТЕМА: ТЕПЛОЕМКОСТЬ ГАЗОВ.
Теплоемкостью называют количество теплоты, которое необходимо сообщить телу (газу), чтобы повысить температуру какой-либо количественной единицы на 1° С.
За единицу количества энергии в системе СИ применяют джоуль (Дж). В системе СИ джоуль является универсальной единицей, применяемой для измерения всех видов энергии: тепловой, механической, лучистой и пр. В качестве тепловой единицы 1 Дж представляет собой такое ее количество, которое появляется в результате превращения механической работы 1 Дж в теплоту. В качестве единицы механической энергии джоуль представляет собой работу, совершаемую силой, равной 1 ньютону при перемещении ею тела на расстояние 1 м в направлении действия силы (1 Дж = Н-м = 1 кг •м2/с2).
В зависимости от выбранной количественной единицы вещества различают мольную теплоемкость μ c — кДж/(кмоль•К), массовую теплоемкость с — кДж/(кг•К) и объемную теплоемкость с' — кДж/(м3•К).
Как было указано выше, 1 м3 газа в зависимости от параметров его состояния имеет разные массы. В связи с этим объемную теплоемкость всегда относят к массе газа, заключенной в 1 м3 его при нормальных условиях (рн = 101325 Па (760 мм рт. ст.) и Т н = 273 К (t н = 0°С).
Для определения значений перечисленных выше теплоемкостей достаточно знать величину одной какой-либо из них. Удобнее всего иметь величину мольной теплоемкости. Тогда массовая теплоемкость
с = μ c / μ, (1)
а объемная теплоемкость
с/ = μ c / 22,4 (2)
Объемная и массовая теплоемкости связаны между собой зависимостью
с/ = с ·ρн
где рн — плотность газа при нормальных условиях.
Теплоемкость газа зависит от его температуры. По этому признаку различают среднюю и истинную теплоемкость.
Если q — количество теплоты, сообщаемой единице количества газа (или отнимаемого от него) при изменении температуры газа от t1 до t2 (или, что то же, от T1 до Т2), то
c m = 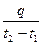 (3)
(3)
представляет собой среднюю теплоемкость в пределах t1 - t2. Предел этого отношения, когда разность температур стремится к нулю, называют истинной теплоемкостью. Аналитически последняя определяется как с=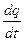
Теплоемкость идеальных газов зависит не только от их температуры, но и от их атомности и характера процесса. Теплоемкость реальных газов зависит от их природных свойств, характера процесса, температуры и давления.
Для газов особо важное значение имеют следующие два случая нагревания (охлаждения):
1) изменение состояния при постоянном объеме;
2) изменение состояния при постоянном давлении.
Обоим этим случаям соответствуют различные значения теплоемкостей.
Таким образом, различают истинную и среднюю теплоемкости:
а) мольную — при постоянном объеме (μсv и μ cvm) и постоянном давлении (μcp и μ срт);
б) массовую — при постоянном объеме (сv и cvm) и постоянном давлении (сp и срт);
в) объемную—при постоянном объеме (c'v и c'vm) и постоянном давлении (с'р и с'рт).
Между мольными теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость (уравнение Майера):
μcp— μ cv = μ R 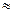 8,314 кДж/(кмоль•К). (4)
8,314 кДж/(кмоль•К). (4)
Для приближенных расчетов при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 5.1).
Таблица 5.1- Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (с= cоnst)
| Газы | Теплоемкость в кДж/(кмоль-К) | |
| μсv | μcp | |
| Одноатомные……… | 12,56 | 20,93 |
| Двухатомные ……… | 20,93 | 29,31 |
| Трех- и многоатомные... | 29,31 | 37,68 |
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k:
k = 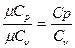
Если принять теплоемкость величиной постоянной, то на основании данных таблицы 5.1 получаем: для одноатомных газов k=1,67; для двухатомных газов k=1,4; для трех- и многоатомных газов k=1,29.
Теплоемкость газов изменяется с изменением температуры, причем эта зависимость имеет криволинейный характер.
Количество теплоты, которое необходимо затратить в процессе нагревания 1 кг газа в интервале температур от t1 до t2,
q= (cm) (t2 -t1) = cm2 t2 - cm1t1, (5)
где cm2 и cm1 – соответственно средние теплоемкости в пределах 0°- t1 и 0°- t2.
В таблицах приводятся интерполяционные формулы для истинных и средних мольных теплоемкостей при постоянном давлении, а также для средних массовых объемных теплоемкостей при постоянном объеме.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 289; Нарушение авторских прав?; Мы поможем в написании вашей работы!