
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия идеального газа
|
|
|
|
Энтропия обозначается буквой S, 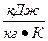 .
.
Основное уравнение для определения изменения энтропии
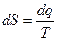 (3)
(3)
Энтропия характеризует наличие теплообмена между рабочим телом и окружающей средой. Если она изменяется, то есть теплообмен между рабочим телом и окружающей средой.
В расчетах используют не абсолютное значение энтропии, а изменение энтропии:
∆s = s 2 – s 1 . (4)
Для газов считают S=0 при нормальных условиях (р=101325 Па, Т=273К или р=760мм.рт.ст. и t = 00С).
Энтропия определяется любой парой ТД параметров состояния:
s = s 1 (p, v), s = s 2 (p, T), s = s 3 (v, T)
По характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен.
Если тело нагревается (∆ q > 0), то его энтропия возрастает (d s > 0).
Если тело охлаждается (∆ q < 0), то его энтропия убывает (d s < 0).
Если тепло не подводитсяк телу (∆ q = 0), то его энтропия постоянна (d s = 0).
Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях обратимого течения процессов:
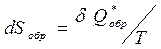 .
.
Принцип возрастания энтропии сводится к утверждению, что энтропия изолированных систем неизменно возрастает при всяком изменении их состояния и остается постоянной лишь при обратимом течении процессов:
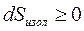 .
.
Оба вывода о существовании и возрастании энтропии получаются на основе какого-либо постулата, отражающего необратимость реальных процессов в природе. Наиболее часто в доказательстве объединенного принципа существования и возрастания энтропии используют постулаты Р.Клаузиуса, В.Томпсона-Кельвина, М. Планка.
В действительности принципы существования и возрастания энтропии ничего общего не имеют. Физическое содержание: принцип существования энтропии характеризует термодинамические свойства систем, а принцип возрастания энтропии – наиболее вероятное течение реальных процессов. Математическое выражение принципа существования энтропии – равенство, а принципа возрастания – неравенство. Области применения: принцип существования энтропии и вытекающие из него следствия используют для изучения физических свойств веществ, а принцип возрастания энтропии – для суждения о наиболее вероятном течении физических явлений. Философское значение этих принципов также различно.
В связи с этим принципы существования и возрастания энтропии рассматриваются раздельно и математические выражения их для любых тел получаются на базе различных постулатов.
Вывод о существовании абсолютной температуры T и энтропии s как термодинамических функций состояния любых тел и систем составляет основное содержание второго закона термодинамики и распространяется на любые процессы – обратимые и необратимые.
Тепловая диаграмма (TS-диаграмма)
В инженерной практике используется графическая зависимость Т(s), которая позволяет в Т, s –координатах изображать количество подведенной к системе (или отведенной) теплоты в обратимом процессе в виде площади под кривой процесса, т.е.
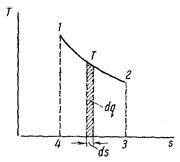
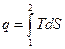 , площадь 1-2- s 2 – s 1 (5)
, площадь 1-2- s 2 – s 1 (5)
В TS-диаграмме состояние тела изображается точкой «·», а всякий обратимый процесс – непрерывной линией.
Рисунок 1 – Тепловая диаграмма
Так как энтропия – есть функция состояния произвольной термодинамической системы, то каждое её состояние отображается точкой на плоскости Т, s.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2179; Нарушение авторских прав?; Мы поможем в написании вашей работы!