
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Соединения элементов подгруппы никеля
|
|
|
|
Металлические и металлоподобные соединения. Никель с металлами УIII группы (крове Ru и Оs), марганцем и медью дает непрерывные твердые растворы. У никеля весьма разнообразны также интерметаллические соединения, например, ряда: Ni3Fе—Ni3Мn—Ni3Cr—Ni3V —Ni3Тi—Ni3Аl. Интерметаллические соединения никеля часто отличаются высокой жаростойкостью и жаропрочностью, являются основой ряда конструкционных материалов для ракетной, газотурбинной и атомной техники. Интерметаллиды входят в состав сплавов никеля, придавая им ценные физико-химические и механические свойства.
К жаропрочным сплавам относятся инконель (73 % Ni, 15 % Сr, 7 % Fе, 2,4 % Тi, остальное Аl, Nb, Мn и Si), нимоник (59 % Ni, 20 % Сr, 16 % Со, 2,3 % Тi, 1,4% Аl, остальное Fе, Мn, Si). Жаропрочностью, жаростойкостью и высоким электросопротивлением обладают хромоникелевые сплавы — нихромы; некоторые из них (например, состава 80 % Ni и 20 % Сr) устойчивы к газовой коррозии до 1000—1100 °С. Нихромы широко применяются в качестве нагревательных элементов в электротехнике. Высокой химической устойчивостью обладает монельметалл (твердый раствор Ni с 30 % Сu), применяемый в химическом аппаратостроении и в домашнем обиходе. Широкое распространение имеют магнитные сплавы никеля типа алнико (cтр. 15), ални (22—24 % Ni, 11—14 % Аl, остальное Fе) и др.
Из железо-никелевых сталей отметим нержавеющую сталь (18 % Сr и 8 % Ni), инвар (36 % Ni, 0,5% Мn и 0,5% С), практически не расширяющийся при нагревании; платинит (0,15% С и 46% Ni), имеющий коэффициент термического расширения, как у стекла, и применяемый как заменитель платины для пайки со стеклом, и пр.
 Соединения Ni (0), Рd (0), Рt (0). Как и у других d -элементов, нулевая (а также отрицательная) степень окисления у никеля и его аналогов проявляется в соединениях с лигандами s-донорного и p-акцепторного типа: СО, РF3, СN-. При этом при электронной конфигурации центрального атома d 10 строение комплексов с лигандами сильного поля чаще всего отвечает структуре тетраэдра (рис. a). В рамках теории валентных связей это соответствует sр 3-гибридизации валентных орбиталей центрального атома:
Соединения Ni (0), Рd (0), Рt (0). Как и у других d -элементов, нулевая (а также отрицательная) степень окисления у никеля и его аналогов проявляется в соединениях с лигандами s-донорного и p-акцепторного типа: СО, РF3, СN-. При этом при электронной конфигурации центрального атома d 10 строение комплексов с лигандами сильного поля чаще всего отвечает структуре тетраэдра (рис. a). В рамках теории валентных связей это соответствует sр 3-гибридизации валентных орбиталей центрального атома:
|
|
|
Рис. 3. Строение молекулы тетракарбонила никеля Ni(CO)4

Никель в нулевой степени окисления образует тетракарбонил Ni(СО)4. В обычных условиях — это бесцветная жидкость (Tпл. —19,3 °С, Tкип. 43 °С). Его получают действием СО на порошок никеля при 60—80 °С. При 180 оС карбонил никеля разлагается, что используется для получения чистого никеля и его покрытий на металлах. Ni(СО)4 применяется также в органическом синтезе в качестве катализатора. Легкость образования Ni(СО)4 используется для разделения никеля и кобальта, так как для получения карбонила кобальта требуются более высокие температура и давление. Так как к тому же летучесть Со2(СО)8 меньше, чем Ni(СО)4, разгонкой их смесей удается достичь высокой степени разделения Ni и Со.
Карбонилы Рd и Рt не выделены. Известны жидкие соединения типа Ni(РF3)4 и Рd(РF3)4.
Для Ni (0) и Рd (0) получены комплексные цианиды К4[Ni(СN)4] и К4[Рd(СN)4] — соответственно медно-красное и желтоватое твердые вещества. Получаются они восстановлением К4[Э(СN)4] в жидком аммиаке калием. Эти соединения — сильные восстановители; например, вытесняют водород из воды:
К4[Э(СN)4] + 2Н2O = K2[Э(СN)4] + 2КОН + Н2
Соединения Ni (II), Рd (II), Рt (II). Несмотря на одинаковую электронную конфигурацию ионов Ni2+, Pd2+ и Рt2+ — d 8, большинство комплексов Ni имеет октаэдрическое строение, в то время как для Рd (II) и Рt (II) типичны плоскоквадратные комплексы.
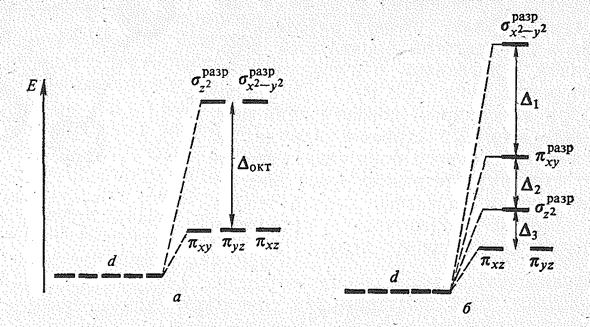
Рис. 4. Порядок молекулярных орбиталей, возникающих из d -орбиталей центрального атома, в октаэдрическом (а) и плоскоквадратном (б) комплексах.
|
|
|
Октаэдрические комплексы Ni (II) парамагнитны, а плоскоквадратные комплексы Рd (II) и Pt (II) диамагнитны. Подобное различие связано с существенным различием в величинах параметра расщепления D. У Рd2+ и как Pt2+-элементов 5-го и 6-го периодов величина параметра расщепления D значительно больше, чем у элемента 4-го периода Ni2+.
При большом значении D в октаэдрическом комплексе два электрона оказываются на сильно разрыхляющих молекулярных s d разр орбиталях. Поэтому энергетически выгодней становятся потеря этих электронов и переход Рd (II) и Pt (II) в степень окисления +4 либо перерождение октаэдрического комплекса в плоскоквадратный. Распределение электронов по молекулярным орбиталям, возникающим при расщеплении d-орбиталей Рd и Pt, в октаэдрическом и плоскоквадратном комплексах показано на рис. 4. Как видно из рисунка, распределение восьми электронов на орбиталях плоскоквадратного комплекса оказывается энергетически выгоднее, чем на молекулярных орбиталях октаэдрического комплекса. Сосредоточение восьми электронов на четырех молекулярных орбиталях определяет диамагнетизм комплексов плоско-квадратного строения.
У никеля (II) плоскоквадратное строение имеет диамагнитньтй нон [Ni(СN)4]2-, что также объясняется высоким значением D, создаваемым на этот раз лигандом сильного поля СN-.
Тетраэдрические комплексы никеля (II) редки; к ним, например, относятся [NiСl4]2-, [NiВr4]2-.
Соединения Ni (II), Рd (II) и Рt (II) интенсивно окрашены. В кристаллах бинарных соединений Ni (II) чаще всего проявляет координационное число 6.
| 
|
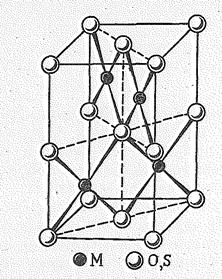
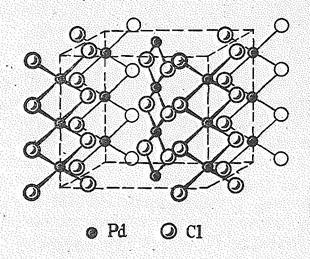
| Рис. 5. Структура РdО, РtО и РtS | Рис. 6. Структура PdCl2 |
Так, NiО имеет структуру типа NаСl; NiF2 — структуру типа рутила; NiСl2, NiBr2, NiI2, Ni(ОН)2 — слоистую структуру типа и т. д. Таким образом, по строению однотипных соединений Ni (П) подобен большинству остальных d -элементов 4-го периода в степени окисления +2.
Структурной единицей соединений Рd (II) и Рt (II) является квадрат. Так, в кристаллах РdО и РtO (рис. 5) атомы Рd и Рt окружены четырьмя атомами кислорода по вершинам четырехугольника, dPdO = 0,201 нм, dPtO = 0,202 им. Эти квадраты соединены сторонами в цепи, которые перекрещиваются под углом 90°. Аналогичное строение имеют РdS и РtS.
 Кристаллы РdСl2 имеют цепное строение с квадратной структурной единицей РdСl4:
Кристаллы РdСl2 имеют цепное строение с квадратной структурной единицей РdСl4:
|
|
|
Дихлорид платины РtСl2 имеет совершенно иное строение. Красно-черные кристаллы РdСl2 состоят из октаэдрических кластерных группировок Рt6Cl12. В отличие от РdСl2 РtСl2 в воде не растворяется, но растворяется в соляной кислоте. Предполагают, что платина дает кластеры, в палладий не дает из-за большой разницы в их энергиях сублимации (атомизации), которая для платины составляет 556 кДж/моль, а для палладия 381 кДж/моль.
Дицианиды палладия Рв(СТ)2 и никеля Тi(СТ)2 — полимеры сетчатого строения с квадратной структурной единицей:

Оксид и гидроксид никеля (II) зеленого цвета. Получают NiО термическим разложением гидроксида, карбоната или нитрата Ni (II). Гидроксид Ni(ОН)2, образуется при действии щелочей на растворы соединений Ni (II) в виде объемистого зеленого геля, который при стоянии постепенно кристаллизуется. NiО и Ni(ОН)2 в воде не растворяются, но взаимодействуют с кислотами.
Оксиды и гидроксиды Рd (II) и Рt (II) черного цвета, в воде не растворяются; РtO устойчив также по отношению к кислотам.
Сульфиды Ni (II) и его аналогов ЭS черного цвета; образуются осаждением сероводородом из растворов соединений Э (II). Свежеполученный NiS растворяется в кислотах, РdS и РtS в кислотах не растворяются. В противоположность Рd (II) и в особенности Рt (II) для Ni (II) характерны соли оксокислот.
 Из катионных комплексов никеля (II) устойчивы октаэдрические гексаакво- и гексаамминокомплексы, имеющие следующую электронную конфигурацию:
Из катионных комплексов никеля (II) устойчивы октаэдрические гексаакво- и гексаамминокомплексы, имеющие следующую электронную конфигурацию:
Аквокомплекс [Ni(ОН2)6]2+ имеет ярко-зеленую окраску (D = 101 кДж/моль). Образуется при растворении в воде солей Ni (II) или же при растворении в кислотах Ni, NiО и Ni(ОН)2. Такая же окраска (различных оттенков) характерна для шестиводных кристаллогидратов Ni(NO3)2×6Н2O, NiSО4×6Н2О, Ni(СlO4)2×6Н2О, NiSnСl6×6Н2O, а также NiSО4×7Н2О, К2Ni(SО4)2×6Н2O и др.
Как показывают структурные исследования, гексагидраты Ni (II) NiX2×6Н2О по структуре делятся на две группы. К первой относятся соединения, в которых все шесть молекул воды входят во внутреннюю, сферу комплексного иона [Ni(OН2)6]Х2, где Х = NО3-, СlО3-, ВrО3-, ClO4- или 2Х = SO42-, SO32- SiF62- и пр.
|
|
|
Ко второй группе относятся - кристаллогидраты, в которых октаэдрическая координация атома Ni создается за счет двух атомов Х(Сl и Вr) и четырех молекул воды [Ni(OН2)4Х2]×2Н2O. Оставшиеся две молекулы Н2O связывают между собой молекулы [Ni(ОН2)4Х2]. Аналогичным образом построен CоCl2×6H2О.
Интересно строение NiCl2×4Н2O. Этот кристаллогидрат представляет собой гексахлороникелат (П) гексааквоникеля (II) [Ni(ОН2)6]2[NiСl6].
Кристаллы NiCl2×2H2О, NiВr2×2Н2O имеют цепную структуру типа CdCl2×2Н3N.
Безводные соли Ni (II) [например, NiF2, NiСl2, NiSО4, Ni(СN)2, Ni(NO3)2 и др.] обычно желтого цвета (разных оттенков), NiI2 черного цвета.
В отличие от ярко-зеленого [Ni(ОН2)6]2+ амминокомплекс Ni(NН3)6]2+ (D 129 кДж/моль) имеет интенсивно синюю окраску. Аммиакаты довольно легко образуются (Кнест = 2×10-9). Например, при взаимодействии твердого NiСl2 с аммиаком:
NiCl2 (т) + 6Н3N (г) = [Ni(NН3)6]Сl2 (т)
Кроме [Ni(ОН2)6]2+ и [Ni(NН3)6]2+ возможны [Ni(ОН2)6-n(NН3)n]2+ смешанные аквоамминокомплексы (n = 1 ¸ 6). Замена лигандов Н2O на лиганды Н3N приводит к изменению окраски комплексов от ярко-зеленого до синего цвета. Это объясняется увеличением параметра расщепления D (изменением энергии d — d -переходов), что приводит к сдвигу полос поглощения в сторону меньших длин волн. Еще больший сдвиг полос поглощения наблюдается в случае этилендиаминовых комплексов [Ni(еn)3]2+ (D = 133 кДж/моль), окраска которых интенсивно-синяя.
За счет образования аммиакатов Ni(ОН)2 легко растворяется в присутствии аммиака и солей аммония:
Ni(ОН)2 (т) + 6H3N (р) = [Ni(NН3)6] (ОН)2 (р)
На образовании устойчивых аммиакатов основаны гидрометаллургические методы извлечения никеля из руд.
Для палладия (II) известен тетракво-ион [Рd(ОН2)4]2+ и несколько кристаллогидратов красновато-бурого цвета Рd(С1O4)3×4Н2O, РdСl3×2Н2O, Рd(NО3)2×2Н2O, РdSО4×2Н2O. Для платины (II) аквокомплексы и соли оксокислот неустойчивы. Из катионных комплексов Рd (II) и Рt (II) очень устойчивы и легко образуются амминокомплексы [Э(NН3)4]2+:
РdСl2 + 4Н3N = [Рd(NН3)4]Сl2
Константы нестойкости [Рd(NН3)4]2+ и [Рt(NН3)4]2+ равны 4×10-30 и 5×10-36 соответственно.
Известно также большое число производных катионных комплексов Ni (II), Рd (II) и Рt (II) с органическими лигандами.
Из анионных комплексов Ni (II) наиболее устойчив желтый [Ni(СN)4]2- (Кнест. = 3×10-31). Его производные образуются при действии на соединения Ni (II) основных цианидов. Вначале получается нерастворимый в воде Ni(СN)2, который затем растворяется в избытке основного цианида:
NiSО4 (р) + 2КСN (р) = Ni(СN)2 (т) + К2SO4 (р)
Ni(СN)2 (т) + 2КСN (р) = K2[Ni(СN)4] (р)
Еще более устойчивы тетрацианидопалладат (II) [Рd(СN)4]2- и тетрацианидоплатинат (II) [Pt(СN)4]2--ионы. (Последний ион характеризуется константой нестойкости 1×10-41.) Известен также Н2[Рt(СN)4]×3Н2O; в водных растворах это сильная двухосновная кислота, называемая платиносинеродистой,
Довольно легко образуются также никелаты (II) типа М+14[NiНаl6], М+14[Ni(SCN)6] и др. В водных растворах эти соединения распадаются.
В отличие от никелатов (II) палладаты (II) и платинаты (П) многообразнее и устойчивее. Например, комплексные галогениды Рd (II) и Pt (II) характеризуются следующими константами нестойкости:

Увеличение устойчивости комплекснцх ионов в ряду производных Сl—Вr-—I- можно объяснить усилением роли p-дативного взаимодействия Э®Наl по мере увеличения размеров свободных d-орбиталей ионов Наl. Усилением p-дативного взаимодействия Э®Х (по мере увеличения подвижности электронных пар центрального атома) можно также объяснить увеличение устойчивости галогенидных и цианидных комплексов при переходе от Рd (II) и Pt (II).
Соли М+12[ЭСl4] (красного цвета) образуются при взаимодействии соединений Рd (II) и Pt (II) в соляной кислоте с соответствующими солями щелочных металлов. Наиболее важны растворимые в воде К9[РtСl4] и Nа2[РСl4] (рис. 7), являющиеся исходными веществами для синтеза различных соединений платины. При синтезе соединений палладия обычно исходят из РdСl2×2H2О.

Рис. 7. Структура К2[РtСl4]
Известны также соединения, в которых Рd (II) и Pt (II) входят одновременно в состав и катиона и аниона, например [Рt(NН3)4] [РtСl4]. Это соединение (зеленого цвета) осаждается при смешивании растворов [Рt(NН3)4]Сl2 и К2[РtСl4]:
[Рt(NН3)4]Сl2 + К2[РtСl4] = [Рt(NН3)4] [РtСl4] + 2КСl
Получен красный [Рd(NН3)4] [РdСl4].
Наряду с катионными и анионными комплексами весьма разнообразны нейтральные комплексы Рd (II) и Pt (II) типа [Э(NН3)4X2] (где Х =Сl-, Вr-, NО2-;). Для соединений этого типа характерна геометрическая (цис—транс) изомерия. Например, составу [Рt(NН3)2Сl2] отвечают два соединения, которые отличаются свойствами, в частности окраской: цис-изомер — оранжево-желтый, транс-изомер — светло-желтый.
 В отличие от транс-изомера цис-изомер обладает ярко выраженной противораковой физиологической активностью. Существенно различны и способы получения этих изомеров. Цис-изомер образуется при замещении двух ионов хлора молекулами аммиака в тетрахлороплатинат (II)-комплексе:
В отличие от транс-изомера цис-изомер обладает ярко выраженной противораковой физиологической активностью. Существенно различны и способы получения этих изомеров. Цис-изомер образуется при замещении двух ионов хлора молекулами аммиака в тетрахлороплатинат (II)-комплексе:
Транс-изомер получается при замещении двух молекул аммиака на ионы хлора в комплексе тетрааммин-платина (II):
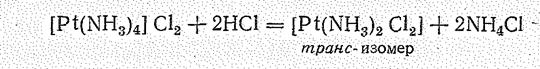
Для понимания направления течения реакций замещения лигандов в комплексах важное значение имеет принцип транс-влияния, установленный И. И. Черняевым (1926). Согласно этому принципу некоторые лиганды облегчают замещение лигандов, находящихся с ним в транс -положении. Экспериментально установлено, что для соединений Pt (II) активность, транс-влияния лигандов увеличивается в ряду

Различным транс-влиянием Н3N и Сl- можно объяснить приведенные выше реакции получения цис- и транс-изомеров [Рt(NН3)2Сl2]:
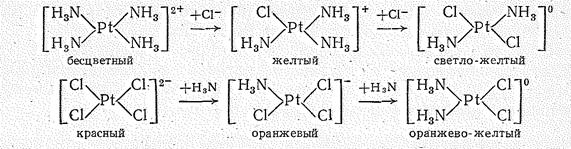
Поскольку транс-влияние Сl- выражено сильнее, чем Н3N, на второй стадии этих реакций замещается лиганд, находящийся в транс-положении к Сl-. Таким образом, исходя из иона [Рt(NН3)4]2+, можно получить только транс-изомер, а из иона [РtСl4]2- — только цис-изомер. Принцип транс-влияния сыграл выдающуюся роль в развитии синтеза комплексных соединений.
Соединения Ni (IV), Рd (IV), Рt (IV). Степень окисления +4 характерна для платины. Производные РсI (IУ) малочисленны и являются окислителями. Еще менее устойчивы и очень редки соединения Ni (IV). Для Pt (IV) известны коричневые (разных оттенков)оксид РtO2, гидроксид Pt(ОН)4 (правильнее РtO2×nН2О), галогениды РtНаl4, сульфид РtS2 и многочисленные производные его катионных, нейтральных и анионных комплексов.
Координационное число Рd (IV) и Pt (IV) равно шести, что отвечает октаэдрической конфигурации комплексов. Последние диамагнитны, имеют следующую электронную конфигурацию: (sсв)12(p d)6.
Бинарные соединения Pt (IV) получают прямым взаимодействием простых веществ при температуре красного каления или путем разложения соответствующих комплексных соединений.
У бинарных соединений Рt (IV) кислотные свойства преобладают над основными. При растворении гидроксида платины (I V) Рt(OH)2 ×nН2O в кислотах и щелочах образуются комплексы анионного типа например:
Рt(ОН)4 + 2NаОН = Nа2[Рt(ОН)6]
Рt(ОH)4 + 6НСl = Н2[РСl6] + 4Н2O
O разнообразии комплексов Pt (IV) можно судить, например, по следующему ряду производных: [Pt(NН3)6]Сl4, [Рt(NН3)5С1]Сl3, [Рt(NН3)4С12]СI2, [Рt(NН3)3С13]Сl, [Рt(NН3)2Сl4], К[Рt(NН3)С15], К2[РtСl6].
Характер координации хлорид-иона в этих соединениях можно легко установить химическим путем. Так, при взаимодействии растворов [Рt(NН3)6]Cl4 и АgNO3 осаждаются 4 моля АgСl в расчете на 1 моль Pt. Из растворов [Рt(NН3)5Сl]Сl3 и [Рt(NН3)4С12]Cl2 выделяются соответственно 3 и 2 моля АgСl, а из раствора [Pt(NН3)2Сl4] хлорид серебра осаждается только в результате долгого стояния раствора или при нагревании. В соответствии с характером ионизации меняется и электрическая проводимость растворов. Понятно, что при одинаковой молярной концентрации максимальной электрической проводимостью обладает раствор [Рt(NН3)6]Cl4, минимальной — раствор [Рt(NН3)2Сl4].
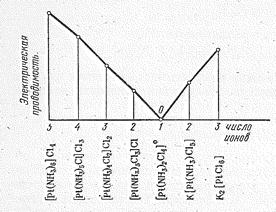
| 
|
| Рис. 8. Молярная электрическая проводимость соединений Рt (IV) в зависимости от их состава. | Рис. 10. Строение кристалла [Рt(NН3)2Сl4]. |
Из аммиакатов Pt (IV) отметим соединения состава [Pt(NН3)6]На14, [Рt(NН3)4Наl2]Наl2 и [Рt(NН3)2Сl4]. для двух последних типов характерна геометрическая изомерия: цис-[Pt(NН3)2С14] имеет оранжевую, а транс-[Рt(NН3)2Сl4] — желтую окраску. Расположение транс-комплексов -[Рt(NН3)2Сl4] в кристалле показано на рис. 10.
Для тетрагалогенидов PtНаl4 очень характерно взаимодействие с галогеноводородными кислотами и основными галогенидами с образованием комплексов типа [PtНаl6]2- (Наl = Сl, Вr, I):
2НСl + РtСl4 = Н2[РtCl6]
2NаС1 + РСl4 = Nа2[РСl6]
Ионы [PtНаl6]2- (за исключением [РtF6]2-) очень устойчивы.
Так, при действии АgNO3 на растворы гексахлороплатинатов (IV) образуется светло-бурый осадок Аg2[РtСl6], а не АgСl. В противоположность Nа2[РiСI6] гексахлороплатинаты (IV) К+, Rb+, Сs+ и NH4+ плохо растворяются в воде и выделяются в виде желтых осадков, что используется для открытия указанных ионов в аналитической практике. Гексахлороплатиновая кислота Н2[PtСl6]×6Н2O — расплывающиеся на воздухе краснокоричневые кристаллы, легко растворимые в воде, спирте, эфире. Получают ее выпариванием растворов продуктов взаимодействия РtСl4 с соляной кислотой или растворения платины в царской водке.
Помимо [РtХ6]2- (Х = Сl-, Вr-, I-, СN-, SCN-, ОН-) известны многочисленные анионные комплексы с разнородными лигандами, например, ряда: М+12[Рt(ОН)6], М+12[Рt(ОН)5Сl], М+12[Рi(ОН)4С12], М+12[Рt(ОН)3Сl3], М+12[Рt(ОН)2Сl4], М+12[Рt(ОН)Сl5], М+12[РtС16]. Не которые из платинат (IV)-комплексов этого ряда могут быть получены при гидролиз РtСl4:
PtСl4 + 2НOН = Н2[Рt(ОН)2Сl4]
или действием щелочей на хлороплатинаты (IV):
Nа2[РtС16] + 6NаОН = Nа2[Рt(ОН)6] + 6NаСl
Соединения никеля (IV) можно получить при окислении фторида никеля (П) фторидом ксенона в присутствии основного фторида, например:
Ni+2F2 + 2СsF + ХеF2 = Сs2Ni+4F6 + Хе
Соединения Рt (VI). Платина, подобно другим 5 d -элементам, образует гексафторид РtF6. Это летучее кристаллическое вещество (Тпл. 61 °С, Ткип. 69 °С) темно-красного цвета, получают его сжиганием платины во фторе. Устойчивость гексафторидов уменьшается в ряду WF6> RеF6> ОsF6> IrF6> РtF6. Особо неустойчив РtF6, он относится к числу наиболее сильных окислителей (сродство к электрону 7 эВ), является самым сильным из всех известных фторирующих агентов. Так, он легко фторирует ВrF3 до ВrF5, бурно реагирует с металлическим ураном, образуя UF6, разлагает воду с выделением кислорода, реагирует со стеклом, Гексафторид платины окисляет также молекулярный кислород до О+2[РtF6]-. Так как первый ионизационный потенциал молекулярного кислорода О2—О2+ равен 12,2 В, т. е. больше, чем у ксенона (12,13 В), было высказано предположение, о возможности образования соединения Хе+[РtF6]-:
Хе + РtF6 = Хе[РtF6]
Вскоре это соединение было получено. Хе[РtF6] - кристаллическое вещество оранжевого цвета, устойчиво при 20 °С, в вакууме возгоняется без разложения. Синтез Хе[РtF6] явился началом широких исследований, приведших к получению соединений благородных газов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 432; Нарушение авторских прав?; Мы поможем в написании вашей работы!