
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Оксид хлора (V) неизвестен
|
|
|
|
Производные [ClO3]- называются хлоратами. Из последних наибольшее практическое значение имеет хлорат калия КСlО3 (бертолетова соль); его получают пропусканием хлора через горячий раствор КОН:
6ОН- + 3Сl2 = 5Cl- + СlO3- + 3Н2О
0 -1 +5
6КОН + 3Cl2 = 5КCl + KClO3 + ЗН2O
или электролизом горячего раствора KCl. Поскольку КСlO3 мало растворим в воде, его легко отделяют от KCl охлаждением раствора.
Триоксохлорат (V) водорода НСlО3 в свободном состоянии не выделен. Но (в отличие от НСlO и НСlО2) известны его концентрированные (до 40%) водные растворы. Водных растворах НСlО3 сильная кислота, называемая хлорноватой. Ее обычно получают обменной реакцией:
Ва(СlО3)2 (р) + Н2SО4 (р) = ВаSО4 (т) + 2НСlO3 (р)
Хлорноватая кислота по свойствам напоминает HNО3, в частности, ее смесь с соляной кислотой сильный окислитель (такого типа, как царская водка),
При нагревании хлораты диспропорционируют:
+5 +7 —1
4КСlO3 = 3KClO4 + КСl
а в присутствии катализатора распадаются с выделением кислорода:
+5 —1 0
2КСlО3 = 2КСl + 3О2
При нагревании триоксохлораты (V) — сильные окислители. В смеси с восстановителями они образуют легко взрывающиеся составы. Бертолетову соль используют в производстве спичек и смеси для фейерверков. Хлорат натрия NаСlО3 применяется в качестве средства для борьбы с сорняками.
Соединения хлора (VII). Высшая степень Окисления хлора +7 проявляется в его оксиде, ряде оксофторидов и отвечающих им анионных комплексах;
Сl2O7 СlO3F СlO2F3 ClOF5 (ClF7)
[ClO4]- [ClO3F2]- [СlO2F4]- — —
Оксид хлора (VII)Сl2O7 — бесцветная жидкость (т. пл. —93,4 °С, т. кип. +83 °С). Получается при нагревании смеси оксохлората (VII) водорода и оксида фосфора (V):
2НСlО4 + Р2O5 = Cl2O7 + 2НРО3
Молекула Cl2O7 полярна (m = 0,24×10-29 Кл×м). В ней согласно электронографическому исследованию два тетраэдра объединены посредством атома кислорода:

Оксид Cl2O7 относительно устойчив, но при нагревании (выше 120 °С) разлагается со взрывом
Тетраоксохлорат (VII)-ион ClO4- имеет тетраэдрическое строение, что в рамках теории валентных связей соответствует sp3 –гибридизации валентных орбитаей атома хлора, стабилизированной за счет p-связей.
Тетраоксохлораты (VII) (называемые еще перхлоратами) весьма многочисленны. Большинство их хорошо растворимо в воде. Тетраоксохлорат (VII) водорода НСlO4 бесцветная жидкость (т. пл. – I02 °С), способная взрываться. Строение молекулы НСlО4:
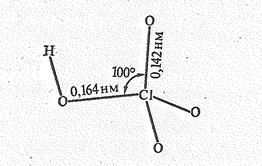
В жидком НСlО4 молекулы димеризованы за счет водородной связи:

Тетраоксохлорат (VII) водорода НСlO4 хорошо растворим в воде. Раствор является хлорной кислотой
Н2О... НСlO4 «ОН3+ + СlО4-
Вследствие ионизации НСlО4 растворы кислоты вполне устойчивы. Хлорная кислота одна из наиболее сильных кислот, Ее получают действием концентрированной Н2SO4 на КСlO4:
КСlO4 + Н2SО4 = НСlO4 + КНSO4
Известны многочисленные оксохлораты (VII). В частности, кристаллогидрат НСlO4×Н2О является перхлоратом оксония [ОН3]СlО4 (т. пл. 49,9 °С). Из оксохлоратов (VII) наибольшее значение имеет КСlО4. Его получают электролизом раствора КСlО3. Перхлораты в основном применяются в производстве взрывчатых веществ, в реактивной технике.
Молекула СlО3F имеет форму несколько искаженного тетраэдра (m = 0,006×10—29 Кл×м). В обычных условиях триоксофторид хлора – перхлорилфторид — бесцветный газ (т. пл. —147,8 °С, т. кип, —46,7 °С) в отличие от Сl2О7 обладает высокой термической и гидролитической стойкостью:
СlО3F устойчив до 500 °С и не гидролизуется даже при 260 оС. Кислотная природа СlО3F проявляется при его взаимодействии с концентрированными растворами щелочей:
СlО3F + 2NаОН = NаСlO4 + NаF + Н2O
СlО3F, как и Сl2O7, — сильный окислитель.
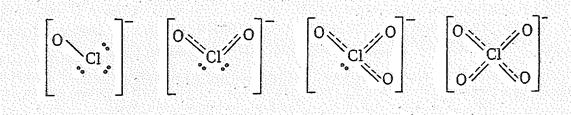
В ряду СlO- — ClО2- — СlО3- — СlO4- по мере увеличения степени окисления хлора устойчивость анионов возрастает. Это можно объяснить тем, что при переходе от СlO- к СlO4- увеличивается число электронов, принимающих участие в образовании связей. Особо устойчив ион СlO4-, в котором все валентные электроны атома хлора принимают участие в образовании связей:
По этой же причине высоко устойчивы тетраэдрические молекула СlО3F и ион [СlО3F]2-.
Полагают, что в ряду СlO- — ClО2- — СlО3- — СlO4- возрастает роль p-связывания. Так, если в СlО- порядок связи равен 1, то в ноне СlО4- он составляет 1,5. Повышение порядка связи Сl–О соответствует увеличению средней энергии связи, уменьшает межъядерное расстояние и повышает силовую постоянную. Так, dClO в СlO- составляет 0,170 нм, в СlО4- — 1,145 нм, а силовые постоянные равны 3,9 и 8,2. Характеристика связи Сl-О рассматриваемых ионов приведена в табл. 2.

Вследствие повышения устойчивости в ряду СlO- — ClО2- — СlО3- — СlO4- уменьшается окислительная активность. Так, гипохлориты вступают в окислительно-восстановительное взаимодействие в любой среде, Хлораты - в растворах окисляют только в сильно кислой среде:
СlО3- + I- + Н2О ® реакция не идет
СlО3- + 6I- + 6Н+ = Сl- + 3I2 + ЗН2О
Окислительная же способность иона СlО4- в растворах практически не проявляется.
Деформация (возбуждение) анионов может происходить также при достаточно сильном нагревании, Поэтому триоксохлораты (V) в расплавах ведут себя как сильные окислители даже в щелочной среде:
+5 +4 сплавл. —1 +6
КСlО3 + 3МnО2 + 6NаОН ¾¾® КСI + 3Nа2MnO4 + 3Н2О
По мере увеличения степени окисления хлора в ряду НСlO — НClО2 — НСlО3 — НСlO4 сила кислот возрастает:
НСlO НClО2 НСlО3 НСlO4
рК…………………..7,3 1,97 ~ -1 ~-10
Этот факт можно объяснить тем, что по мере увеличения числа атомов кислорода в ряду СlO- — ClО2- — СlО3- — СlO4- прочность связи О — Н с определенным атомом кислорода ослабевает.
Соединения хлора (II), (IV) и (VI). Можно считать, что степень окисления +2, +4 и +6 хлор проявляет следующих оксидах: Сl2О4, СlО2, СlО3, Сl2О6.
В обычных условиях д и о к с и д хлора СlО2 зеленовато-желтый газ (Тпл. —59 °С, Ткип. 9,9 °С) с резким запахом. Это — эндотермическое соединение (DНоf = +105 кДж/моль). Молекула СlО2 имеет угловую форму (Ð ОСlО = 118°, d ClO = 0,148 нм), поэтому она полярна (m = 0,56 × 10-2 9 Кл×м):

Молекула парамагнитна, так как имеет нечетное число элементов.
Таким образом, СlО2 — валентно-ненасыщенное соединение; в нем заложена тенденция к присоединению или потере одного электрона:
+4 +3 +4 +5
СIО2 + е- = С1О2- ; СlО2 — е- = СlО2+
Наиболее отчетливо проявляется первая тенденция (сродство к электрону СlO2 равно 3,43 эВ); СlO2 – сильный окислитель, например, окисляет в щелочной среде:
+4 +3
РbО + 2ClO2 + 2NаОН = РbO2 + 2NаСlO2 + Н2O
На этой реакции основан один из способов производства NаСlО2.
Отрыв электрона от СlО2 (энергия ионизации 11,1 эВ) наблюдается в солеподобных соединениях иона [ClO2]+, например (ClO2)[ВF4], (СlО2)2[SiF6] и др.
Тенденция к присоединению и потере электрона легче всего реализуется при диспропорционировании СlО2 в водных (в особенности в щелочных) растворах:
+4 +3 +5
2СlО2 + 2ОН- = С1О2- + С1О3- + Н2O
При этом образуются две кислоты (или две соли).
Диоксид хлора постепенно разлагается на свету. При небольшом нагревании, ударе или соприкосновении с горючими веществами СlO2 разлагается со взрывом.
Один из технических методов получения СlО2 основан на реакции восстановления NаСlО3 диоксидом серы в растворе серной кислоты при нагревании
2NаСlО3 + SО2 + Н2SО4 = 2NаНSО4 + 2СlО2
Диоксид хлора применяется для отбелки бумажной массы и в качестве сильного окислителя в некоторых технологических процессах.
Оксид С12О4 получен сравнительно недавно (1970). Он имеет структуру хлората (VII) хлора (I) Сl—О—СlО3. Это светло-желтая жидкость (т. кип. 44,5 °С).
Триоксид хлора СlО3 — неустойчивый короткоживущий радикал, обнаружен методом ЭПР.
Оксид Сl2О6 в обычных условиях — темно-красная маслообразная жидкость, замерзающая при +3 °С. Полагают, что его молекула имеет несимметрич
+5 +7
ную структуру O2Сl—О—СlО3. В кристаллическом состоянии имеет ионное строение — построен из ионов СlО2+ и СlО4-. Получают его окислением СlО2 озоном. При обычных температурах Сl2О6 постепенно разлагается. Энергично взаимодействует с водой, образуя за счет диспропорционирования хлорноватую и хлорную кислоты:
+5 +7 +5 +7
Сl2О6 (O2Сl—О—СlО3) + НОН = НСlО3 + НСlО4
При соприкосновении с органическими веществами Сl2О6 взрывается.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3481; Нарушение авторских прав?; Мы поможем в написании вашей работы!