
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамика химических реакций
|
|
|
|
Связь между концентрацией, давлением и конверсией

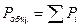
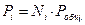


Используя приведенные выше формулы получим:
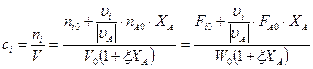
Пример:
A → B + Z
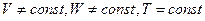
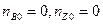
Необходимо найти:  .
.


Аналогично находится сZ.
В этой задаче концентрацию можно заменить на давление, так как предполагаем, что T = const.

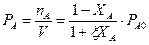

Химическая термодинамика изучает применение законов термодинамики к химическим и физико-химическим процессам. Сама термодинамика подразделяется на 3 составляющих:
1. Термохимия, которая рассматривает энергетические эффекты реакции на основе первого начала термодинамики.
2. Изучение термодинамических функций. Изменение которых определяет устойчивость системы, направление самопроизвольного протекание процесса и равновесие на основе второго начала термодинамики.
3. Изучение констант равновесия и расчет концентраций участников реакций в момент равновесия на основании второго и третьего законов термодинамики.
Первый закон термодинамики – закон сохранения энергии: энергия не исчезает никуда и не возникает ниоткуда, а просто переходит из одной формы в другую.
Закон Гесса: если химический процесс осуществляется без изменения давления и температуры и в отсутствии полезной работы, то количество энергии, которая система выделяет или поглощает в форме теплоты равно изменению энтальпии системы.
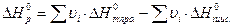
Второй закон термодинамики: невозможна самопроизвольная передача теплоты от более холодного тела к более тёплому. То есть, этот закон говорит, что для необратимых процессов:  .
.
Третий закон: при приближении к абсолютному нулю энтропии чистых тел в конденсированном состоянии равна нулю.
При постоянной температуре и объеме процесс описывается функцией Гельмгольца (изохорно-изотермический) T = const, V = const:
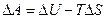
Обычно пользуются уравнением Гиббса, так как большинство химических реакций идут при постоянном давлении T = const, P = const (изобарно-изотермический):
 .
.
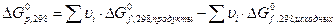

За стандартное состояние вещества принимается состояние вещества в виде идеального газа (для газов и паров) при стандартных условиях.
Для жидкостей и кристаллов за стандартное состояние принимается состояние, соответствующее фиктивному состоянию идеального газа.
Все эти величины приведены в таблицах и рассчитываются при наиболее стабильной модификации, и рассчитываются за счет того, что соединение состоит из простых веществ.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 366; Нарушение авторских прав?; Мы поможем в написании вашей работы!