
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Способы получения. Тетрахлорид урана представляет собой темно-зелёное кристаллическое вещество растворимое в воде, структура – гранецентрированная тетрагональная
|
|
|
|
Свойства
Тетрахлорид урана
Тетрахлорид урана представляет собой темно-зелёное кристаллическое вещество растворимое в воде, структура – гранецентрированная тетрагональная. Плотность r (теор.) = 4,87 г/см3, r (практ.) = 4,73÷4,90 г/см3. Температуры фазовых переходов: t (плавл.) = 590 ± 1 оС, t (кипения) = 792 ± 2 оС.
UCl4 гигроскопичен, образует UCl4·2H2O. Вещество склонно к гидролизу:
UCl4·2H2O + H2O → UOCl2·2H2O + 2 HCl
UOCl2·2H2O + H2O → U(OH)4 ↓ + 2 HCl
В итоге:
UCl4 + 4 H2O → U(OH)4 ↓ + 2 HCl t < 110 oC
UCl4 + 2 H2O → UO2 + 4 HCl t > 110 oC
В растворе также возможно образование гидроксокатионов:
U4+ + 2 H2O → UOH3+ + H+
Тетрахлорид урана может быть окислен до оксихлорида или высших хлоридов и даже до оксида:
UCl4 + ½ O2 → UIVOCl2 + Cl2
UCl4 + ½ O2 → UVOCl3 + ½ Cl2
UCl4 + O2 → UVIO2Cl2 + Cl2
3 UO2Cl2 + O2 → U3O8 + 3 Cl2
Способ 1. Хлорирование оксидов урана хлором в присутствии углерода, например:
U3O8 + 2 С → 3 UO2 + 2 CO t = 900 oC
UO2 + C + 2 Cl2 → UCl4 + CO2 t = 800 oC
Очень важная стадия, определяющая приемлемость процесса, – это конденсация хлорида. Один из вариантов – получение систем на расходуемой насадке LiCl, NaCl, KCl, MgCl2, CaCl2. Образование низкоплавких эвтектик способствует более полному улавливанию продукта и облегчает его отделение.

|
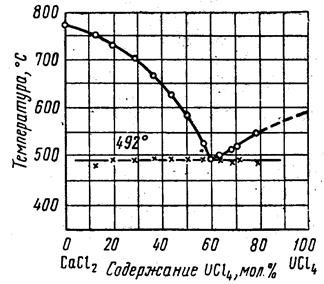
|
| Диаграмма состояния системы KCl-UCl4. | Диаграмма состояния системы СаCl2-UCl4. |
Способ 2. Хлорирование оксидов урана четырёххлористым углеродом:
UO2 + CCl4 → UCl4 + CO2 t > 450 oC
Недостатком метода является возможность образования фосгена (COCl2):
UO2 + 2 CCl4 → UCl4 + 2 COCl2
COCl2 → CO + Cl2
2 CO ↔ CO2 + C
Сажистый углерод может загрязнить UCl4, придётся его направлять на очистку перегонкой. Для того, чтобы этого избежать необходимо регулировать подачу паров CCl4. Скорость подачи должна соответствовать кинетике первой реакции.
Способ 3. Хлорирование UO3 в жидком гексахлоропропилене (tпл.= -70 оС, tкип.= 210 оС):
UO3 + CCl3–CCl=CCl2 → UCl4
Процесс идёт при 180-190 оС, т.е. ниже температуры кипения гексахлоропропилена. Полученный UCl4 отделяют и промывают безводным CCl4. Продукт сушат при пониженном давлении при t=300-350 oC. Чистота [Cl]/[U]=3,96.
Основные области использования тетрахлорида урана:
· электромагнитное разделение изотопов урана (в настоящее время устаревшее);
· получение обогащённого металлического урана.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 604; Нарушение авторских прав?; Мы поможем в написании вашей работы!