
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основные индикаторы. В растворе нет ионов Al3+ и S2- и сразу образуется осадок Al(OH)3 и газ H2S, которые выводят из сферы реакции катионы и анионы
Пример
Al2S3(тв) + 6H2O = 2Al(OH)3(тв) + 3H2S(г).
В растворе нет ионов Al3+ и S2- и сразу образуется осадок Al(OH)3 и газ H2S, которые выводят из сферы реакции катионы и анионы.
Если соль образована слабым основанием и слабой кислотой, то при растворении в воде идет одновременно гидролиз по катиону и аниону до конца, то есть соль разлагается полностью на исходное основание и кислоту. При этом среда в зависимости от соотношения констант диссоциации слабых основания и кислоты может быть любой: кислой, нейтральной или основной. рН среды в таких случаях, как правило, определяют экспериментально.
Влияние на растворимость рН среды раствора.
рН гидратообразования
Осаждение малорастворимых гидроксидов металлов
Одним из важнейших факторов, влияющих на растворимость, является рН среды.
В состав осадка малорастворимого гидроксида металла Ме(ОН)z входит ион ОН -. Произведение растворимости для Ме(ОН)z, согласно уравнению (51):
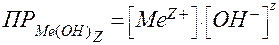 .
.
Если к раствору соли, образованной слабым основанием и сильной кислотой (рН<7), добавлять щелочь, то при определенном добавленном количестве щелочи начнется гидратообразование - выпадение осадка малорастворимого гидроксида:
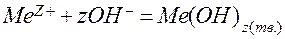 .
.
рН начала гидратообразования можно рассчитать по формуле, выведенной из уравнения:
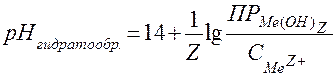
Задача.
Рассчитайте величину рН, необходимую для полного осаждения гидроксида магния Mg(OH)2 из раствора его соли, т.е. до остаточной концентрации ионов Mg2+ - СMg2+ 10-6 моль/л.
10-6 моль/л.
Решение. Воспользуемся формулой ПР, подставив в нее справочную величину
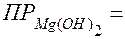 1,8∙10-11 и
1,8∙10-11 и 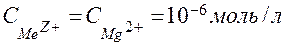 :
:
рНгидратообр.=  11,75.
11,75.
Ответ: Полное осаждение Mg2+-ионов из водных растворов в виде Mg(OH)2 достигается при рН ≥11,75.
Осаждение малорастворимых гидроксидов – кислот.
Если к раствору соли, образованной сильным основанием и слабой кислотой приливать сильную кислоту, то при определенном количестве добавленной кислоты начнется гидратообразование - выпадение осадка малорастворимой кислоты:
AnZ- + nH+ = HZAn(ТВ).
Согласно уравнению, выражение для произведения растворимости малорастворимой кислоты HnAn(ТВ.) имеет вид:
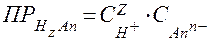 .
.
рН начала гидратообразования – выпадения осадка малорастворимой кислоты – можно рассчитать из уравнения (55):
рНгидратообр. = 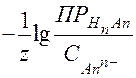 ,
,
где z - заряд аниона,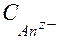 - начальная концентрация аниона в растворе.
- начальная концентрация аниона в растворе.
К раствору соли Na2WO4 c концентрацией 0,13 моль/л добавляют раствор соляной кислоты. Рассчитайте, при каком значении рН начинается выпадение осадка малорастворимой вольфрамовой кислоты.
Решение. Осадок кислоты выпадает в результате реакции в растворе:
Na2WO4 + HCl = H2WO4(ТВ.) + 2 NaСl.
Произведение растворимости вольфрамовой кислоты:
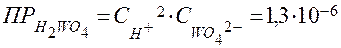 .
.
Уравнение гетерогенного равновесия имеет вид:
H2WO4(ТВ.)  2Н+ + WO42-.
2Н+ + WO42-.
Из уравнения выведем формулу для расчета рН начала выпадения малорастворимой кислоты Н2WO4:
рН = -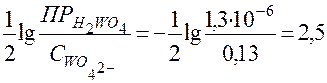 .
.
Ответ. В заданных условиях осадок малорастворимой
вольфрамовой кислоты начнёт выпадать при рН ≤ 2.5
|
Дата добавления: 2014-01-07; Просмотров: 733; Нарушение авторских прав?; Мы поможем в написании вашей работы!