
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Подобное растворяется в подобном: полярное – в полярном, неполярное – в неполярном
|
|
|
|
Твердые растворы могут быть образованы твердыми (кристаллическими) веществами: металлами (сплавы), солями, оксидами металлов. Твердым раствором называют кристалл, кристаллическая решетка которого построена из двух или нескольких компонентов.
Металлические твердые растворы благодаря их высокой однородности широко используются в машиностроении, приборостроении в качестве конструкционных материалов, устойчивых к коррозии. Например, однофазная аустенитная сталь 1Х18Н9 («нержавеющая сталь») представляет собой твердый раствор, содержащий 18% хрома, 9% никеля и не более 0,1% углерода в γ-железе.
Отличительные свойства растворов:
1) от смесей – гомогенность
2) от химических соединений – переменность состава, изменение свойств растворителя и растворенного вещества не носит радикального характера.
По характеру взаимодействия растворяемого вещества с растворителем растворы бывают:
- ионного типа (растворы электролитов)
- молекулярного типа (растворы неэлектролитов).
Вещества с ионным типом химической связи в молекуле (ионные вещества), если их удается растворить в воде, образуют растворы ионного типа. Например. при растворении в воде ионного вещества NaCl образуется однородная смесь ионов Na+ и Cl– с водой.
При растворении большинства газов, органических веществ и некоторых неорганических веществ их молекулы остаются недиссоциированными. Такие растворы называют молекулярными. Растворенное вещество в них просто распределено в виде отдельных молекул между молекулами растворителя. Например, кислород, когда растворяется в воде, то существует в ней в виде молекул О2.
Главное отличие ионных растворов от молекулярных заключается в том, что ионные растворы проводят электрический ток, а молекулярные – нет.
В зависимости от концентрации растворенного вещества растворы:
- концентрированные – содержание растворенного вещества свыше 5% массовых;
- разбавленные – содержание до 5%.
Раствор, содержащий при данной температуре максимально возможное количество растворенного вещества и находящийся в равновесии с избытком растворяемого вещества, называют насыщенным (рис.2).

Рис. 1. Динамическое равновесие в насыщенном растворе.
Способность вещества растворяться в том или ином растворителе называют растворимостью. Численно растворимость вещества равна концентрации его насыщенного раствора. Для характеристики растворимости также используют коэффициент растворимости – масса вещества, при растворении которой в 100 г растворителя при данной температуре, образуется насыщенный раствор. Этот показатель зависит от температуры, при которой происходит растворение.
Ненасыщенный раствор – раствор, в котором содержание растворенного вещества меньше, чем его растворимость.
Пересыщенный раствор – раствор, в котором содержание растворенного вещества больше, чем его растворимость. Такие растворы можно получить при осторожном переохлаждении. Пересыщенные растворы метастабильны (условно стабильны), так как при внесении в такой раствор какой-либо затравки или при перемешивании возможно самопроизвольное выделение избытка растворенного вещества (либо выпадает осадок, либо появляется еще одна жидкость).
Универсальной теории растворения веществ нет, но существует эмпирическое правило:
(демонстрация растворения йода в воде с йодидом калия и спирте, четыреххлористого углерода в воде)
При растворении одного вещества в другом происходят следующие процессы:
1) смачивание
2) разрушение кристаллической решетки твердого вещества
3) сольватация (гидратация, если растворитель – вода)
4) диссоциация.
При растворении веществ могут происходить химические реакции между молекулами растворяемого вещества и растворителя, а могут и не происходить. Когда растворение вещества не сопровождается явно выраженной химической реакцией, между растворяемым веществом и растворителем происходит взаимодействие, которое называют сольватацией. Однако сольватация – это широкое понятие, относящееся к любому растворителю. Когда же растворителем является вода, это взаимодействие называют гидратацией. В результате гидратации образуются ассоциированные группы частиц, которые называют гидратами. Например, Al(H2O)63+, Cu(H2O)42+, Ni(H2O)62+, Со(Н2О)62+. Количество молекул воды зависит от:
1) размера катиона металла и его заряда,
2) строения атома металла.
Маленькие по размерам катионы металлов могут быть окружены лишь небольшим количеством молекул воды, но большой ион (например, Ce3+, K+, Na+) может присоединить к себе много молекул воды.
Способность воды гидратировать ионные вещества объясняется ее одной особенностью – большой величиной диэлектрической проницаемости ε. Диэлектрическая проницаемость служит мерой способности вещества ориентировать свои молекулы в электрическом поле и зависит от дипольного момента молекулы. Например, для воздуха ε=1, а для воды ε≈100. Следовательно, молекулы воды обладают большей способностью ориентироваться в электрическом поле.
Процесс растворения начинается с ориентации диполей воды вокруг всех выступов и граней кристалла (рис. 1). Поверхностные ионы K+ и Cl– гидратируются. Причем, энергия гидратации оказывается сильнее, чем энергия связи ионов в кристаллической решетке. Поэтому гидратированные поверхностные ионы K+ и Cl– освобождаются от непосредственного окружения в кристаллической решетке и переходят в раствор, а процессу гидратации подвергается следующий, более глубокий слой.
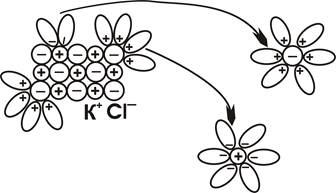
Рис. 2. Растворение кристалла хлорида калия в воде.
Растворение, как правило, сопровождается каким-либо тепловым эффектом. Тепловая энергия, которая выделяется или поглощается при растворении 1 моль вещества с образованием 1 л раствора, называется молярной энтальпией растворения.
Относительное содержание вещества в растворе характеризуется его концентрацией.
Способы выражения концентрации растворов
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3339; Нарушение авторских прав?; Мы поможем в написании вашей работы!