
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз соли по аниону
Пример
0,05 г соли Al2(SO4)3 растворили в 100 см3 воды. Чему равна величина pH полученного раствора?
Решение. Уравнение электролитической диссоциации соли:
 ⇄
⇄ 
Al3+ “наследует” свойства слабого основания Al(OH)3 (KIдисс.< 10−2);
(SO4)2− “наследует” свойства сильной кислоты H2SO4 (КIдисс.> 10−2).
Если гидролизу подвергается многозарядный катион, то гидролиз может протекать по стадиям, а число стадий гидролиза равно заряду катиона.
Для катиона Al3+ возможны 3 стадии гидролиза.
Ионное уравнение гидролиза по 1-ой стадии:


|
|
 ⇄
⇄  .
.
KIдисс.= 1,8∙10−9, KIIIдисс.= 1,4∙10−16- это последняя константа диссоциации слабого основания Al(OH)3.
Равновесие реакции сдвинуто влево, в сторону более слабого электролита - воды:
( <
< 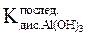 ), следовательно
), следовательно  >
>  .
.
Ионы (SO4)2− в реакции не участвуют.
Молекулярное уравнение 1-ой стадии гидролиза:
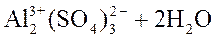 ⇄
⇄ . (равновесие сдвинуто влево)
. (равновесие сдвинуто влево)
Так как в результате реакции гидролиза в растворе появляются свободные ионы Н+, то pH < 7 (среда кислая).
Расчет pH 1-ой стадии гидролиза в растворе Al2(SO4)3.
Необходимо перевести заданную концентрацию соли в мольную:

Мольная масса Al2(SO4)3 
 .
.

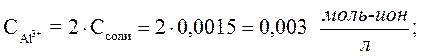
 .
.
Ответ: рН раствора соли Al2(SO4)3 заданной концентрации равен 3,83.
Так как гидролиз соли – реакция эндотермическая, в соответствии с принципом Ле-Шателье о сдвиге равновесия, повышение температуры приводит к увеличению степени гидролиза β. Нагревание способствует гидролизу (сдвигу равновесия вправо). Добавление воды (разбавление раствора) приводит к усилению гидролиза.
Усиление ступенчатого гидролиза солей многокислотного слабого основания и сильной кислоты может привести к образованию малорастворимых основных солей, тогда равновесие гидролиза сильно сдвигается вправо.
Гидролиз соли по катиону можно предотвратить, если растворять соль в заранее подкисленном растворе. В данном случае перед растворением соли Al2(SO4)3 необходимо в воду добавить кислоту H2SO4 в таком количестве, чтобы величина pH стала меньше 3,83.
Добавление щелочи в таком количестве, чтобы величина pH стала больше 3,83 вызовет сдвиг равновесия вправо, т.е. будет способствовать гидролизу. Поэтому при нагревании, разбавлении и добавлении щелочи могут протекать последующие стадии гидролиза.
Как правило, гидролиз идет лишь по первой стадии в силу выше описанных причин. Но если существуют условия для сдвига равновесия реакции гидролиза, то возможно протекание последующих стадий.
2-ая стадия гидролиза
Ионное уравнение 2-ой стадии гидролиза:


 ⇄
⇄  ;
;




 ⇄
⇄  .
.
Расчет рН, β, КГ гидролиза можно провести, руководствуясь теми же представлениями, что и для 1-ой стадии гидролиза.
3-я стадия гидролиза:
|

|

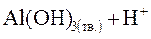 ;
;

|
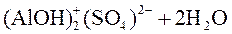
 .
.
В данном случае 3-я стадия гидролиза идет до конца, так как образуется малорастворимое соединение Al(OH)3.
Рассмотрим гидролиз соли, образованной сильным основанием и слабой кислотой, например, КF. Реакция полной диссоциации соли:
КF ⇄ K+ + F-.
Гидролизу подвергается анион слабой кислоты F-:
F- + H2O ⇄ HF + OH-.
Суммарная реакция гидролиза в молекулярном виде:
КF + H2O⇄ HF + КОН.
Из уравнения реакции гидролиза следует, что в растворе появляется некоторое избыточное количество ОН--ионов, т.е. раствор подщелачивается. Степень гидролиза β и константа гидролиза КГ в данном случае описываются теми же уравнениями, как и в предыдущих примерах, но вместо константы диссоциации слабого основания входит константа диссоциации слабой кислоты.
Равновесную концентрацию ионов ОН- вычисляем из уравнения:
 = β∙СAn =
= β∙СAn =  .
.
Соответственно, водородный показатель среды рассчитывается по уравнению:

Следовательно, гидролиз соли, образованной сильным основанием и слабой кислотой, идет по аниону и приводит к подщелачиванию раствора. рН среды вычисляется по формуле:  ,
,
где  ;
; 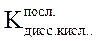 –- последняя константа диссоциации слабой кислоты (справочная величина); Cан., моль/л – исходная концентрация анионов соли.
–- последняя константа диссоциации слабой кислоты (справочная величина); Cан., моль/л – исходная концентрация анионов соли.
|
Дата добавления: 2014-01-07; Просмотров: 2037; Нарушение авторских прав?; Мы поможем в написании вашей работы!