
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второе начало термодинамики
|
|
|
|
Обратимый процесс между любыми двумя точками можно разделить на два (рис.7.11). Сумма интегралов по контурам 1 - 2 и 2 - 1 в обратимом процессе равна нулю:
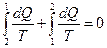 (7.5.1)
(7.5.1)
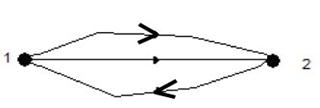
Рис.7.11..Интеграл по замкнутому контуру в обратимом процессе из точки 1-2 и обратно 2-1.
Таким образом, интеграл между любыми равновесными состояниями не зависит от пути и равен нулю.
Это позволяет ввести новую физическую величину, которая получила название энтропии S:
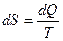 (7.5.2)
(7.5.2)
В этом случае выражение (7.4.6) может быть переписано в виде:
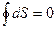
для обратимого цикла. Изменение энтропии ΔS между точками 1 и 2 на рис.7.11 определяется выражением:
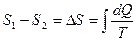 . (7.5.3)
. (7.5.3)
Энтропия является параметром состояния системы, поскольку зависит от состояния системы и не зависит от процесса, посредством которого эта система пришла в это состояние. Энтропия напоминает потенциальную энергию, поскольку для нее неизвестно абсолютное значение, интерес представляет лишь ее изменение.
Понятие энтропии было введено австрийским ученым Л.Больцманом[5]. Физический смысл энтропии объясняется введением другого понятия - фазового объема (Ф). Фазовый объем отличается от понятия обычного объема тем, что он содержит три пространственные и три импульсные координаты для каждой частицы. Когда система содержит N частиц, то количество координат, которые описывают систему, составит 6N. Таким образом, фазовый объем состоит из N микрообъемов (Ф0) или микросостояний. Фазовый объем системы определяется ее макропараметрами (объемом, давлением, температурой) и представляет макроскопическое состояние системы. Величина 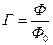 выражает число микросостояний, соответствующее данному макросостоянию или числу способов, которыми оно может быть получено. В молекулярной физике величину
выражает число микросостояний, соответствующее данному макросостоянию или числу способов, которыми оно может быть получено. В молекулярной физике величину  называют термодинамической вероятностью рассматриваемого макросостояния.
называют термодинамической вероятностью рассматриваемого макросостояния.
|
|
|
Для понимания смысла термодинамической вероятности приведем пример с двумя кубиками с пронумерованными сторонами. В сумме на них может выпасть от 2 до 12. Наиболее вероятным числом будет 7, поскольку оно может быть получено наибольшим числом способов: 1+6=2+5=3+4=4+3=5+2=6+1. Количество комбинаций представляет термодинамическую вероятность макросостояния.
Это можно понять на примере. Из воздуха в изолированной комнате нам необходимо выделить какую-то составляющую, например, газ СО2 и собрать ее в одной из половин комнаты. Термодинамическая вероятность того, что это произойдет самопроизвольно, равна вероятности того, что молекулы данной примеси одновременно окажутся в одной половине. Интуитивно понятно, что эта вероятность ничтожна мала.
С использованием понятия энтропии второе начало термодинамики формулируется следующим образом: полная энтропия произвольной системы вместе с её окружением в любом естественном процессе увеличивается: 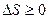 .
.
Такая формулировка представляет собой наиболее общее определение второго начала термодинамики. Она характеризует направленность процессов в природе. Энтропия описывает переход от порядка к хаосу. Чем выше степень беспорядка, тем выше энтропия системы. Таяние льда или превращение в пар воды приводит к возрастанию энтропии, поскольку степень беспорядка в системе возрастает. Жизнь и смерть. Живой организм – это сильно упорядоченная структура. После смерти он превращается в набор атомов и молекул, то степень беспорядка в системе возрастает. Если в квартире не производить уборку, то в ней со временем возникнет сильный беспорядок (бардак).
На практике используется еще одна формулировка второго начала термодинамики:
Все самопроизвольные процессы в любой неравновесной системе происходят в таком направлении, при котором энтропия системы возрастает, пока, наконец, не достигнет своего максимального значения, соответствующего состоянию теплового равновесия.
|
|
|
Такие процессы могут происходить только в замкнутых системах. В незамкнутых системах неизбежны внешние влияния на систему, приводящие и к убыванию энтропии. Так, например, в холодильнике в результате совершения работы теплота переходит от холодных предметов к теплым, а не наоборот.
Одно время достаточно широко обсуждалась теория тепловой смерти Вселенной: возрастание энтропии приводит к приближению температуры к абсолютному нулю. Однако в этом случае выводы, верные для замкнутых систем распространялись на открытые системы, каковой является наша Вселенная.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 329; Нарушение авторских прав?; Мы поможем в написании вашей работы!