
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Мышьяк, сурьма, висмут
|
|
|
|
ФОСФОР
АЗОТ
Основная масса азота в природе находится в земной атмосфере (78 об.%) в виде простого вещества N2. В связанном виде азот входит в состав белков всех растительных и животных организмов. Редко встречаются минералы азота: чилийская селитра - NaNO3 и индийская селитра - KNO3, которые имеют биогенное происхождение.
Простое вещество - азот (диазот) N2,бесцветный газ (tкип=-195,80С, tпл.=-2100С), без запаха и вкуса, малорастворимый в воде (23 мл в 1 л холодной воды). Молекула азота двухатомная. Кратность связи в молекуле N2 равна 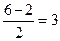 . Энтальпия тройной связи составляет -940,5 кДж/моль. Это одна из самых прочных молекул. Жидкий и твёрдый азот также построен из молекул N2, связанных силами Ван-дер-Ваальса.
. Энтальпия тройной связи составляет -940,5 кДж/моль. Это одна из самых прочных молекул. Жидкий и твёрдый азот также построен из молекул N2, связанных силами Ван-дер-Ваальса.
Прочность и неполярность молекулы N2, близость энтальпии ионизации молекулы (1402 кДж/моль) к энтальпии ионизации аргона объясняют её химическую инертность по отношению к многим веществам. В обычных условиях азот используют для создания инертной атмосферы вместо более дорогих благородных газов. Азот проявляет очень слабые восстановительные и окислительные свойства (энергия сродства к электрону -3,6 эВ). При комнатной температуре он реагирует только с литием. В случае инициирования реакций нагреванием, электрическим разрядом или ионизирующими излучениями, а также в присутствии катализаторов, азот взаимодействует с сильными окислителями и восстановителями:
N2 + O2 Þ 2NO (в электрическом разряде),
N2 + 6Li Þ 2Li3N (при обычной температуре),
N2 + 2Ti Þ 2TiN (при t=12000С),
N2 + 3H2 Û2NH3 (при 400-5000С, катализатор).
Соединения азота в отрицательных степенях окисления. Основными соединениями азота, в которых он проявляет отрицательные степени окисления, являются
-3 -2 -1
аммиак (NH3), гидразин (N2H4), гидроксиламин (NH2OH)
и их многочисленные неорганические и органические производные.
Кислородные соединения азота. Азот образует большое число оксидов N2O, NO, N2O3, NO2, N2O4, N2O5 и очень неустойчивые N4O и NO3. Стандартная энергия Гиббса DG0 образования всех оксидов больше нуля. Поэтому при обычных условиях непосредственным взаимодействием азота с кислородом оксиды получить нельзя. Однако анализ термодинамических характеристик образования молекулы NO (DH0=180,6 кДж/моль, DS0=24 Дж/(моль×К)) свидетельствует о том, что реакция протекает с возрастанием энтропии и возможна при высокой температуре, так как с увеличением температуры DG=DH-TDS может стать меньше нуля.
Действительно, взаимодействие азота с кислородом с образованием NO происходит при ~30000С:
N2 + O2 Û 2NO,
В природе NO образуется в атмосфере при грозовых разрядах, а также при сгорании топлива в высокофорсированных бензиновых двигателях. И в том и другом случаях реакция протекает с затратой энергии.
Азотистая кислота – HNO2 – известна только в растворе. Водные растворы окрашены в голубой цвет, при небольшом нагревании или концентрировании растворов кислота разлагается:
3HNO2Þ HNO3 + H2O + 2NO.
HNO2 - слабая кислота (К a =5×10–4).
Соли азотистой кислоты – нитриты – устойчивы. Нитриты щелочных металлов при нагревании даже возгоняются без разложения. Нитриты хорошо растворимы в воде и частично гидролизуются:
NO2– + H2O Û HNO2 + OH–.
Азотная кислота – HNO3 – бесцветная жидкость (tпл.=-41,60С, tкип.=+84¸+870С), которая на свету или при хранении частично разлагается с выделением NO2:
4HNO3 Û 4NO2 + O2 + 2H2O,
и окрашивается продуктами разложения в бурый цвет.
В водных растворах HNO3 - типичная кислота и реагирует с основаниями с образованием солей (нитратов):
HNO3 + NaOH Þ NaNO3 + H2O.
Она растворяет почти все металлы, кроме Au, Pt, Ru, Ir, Rh, Os. Являясь сильным окислителем, HNO3 окисляет металлы благодаря нитрат-иону. Продукты восстановления азотной кислоты определяются её концентрацией, силой восстановителя и температурой.
Некоторые металлы (Al, Cr, Ti, Fe и др.) в азотной кислоте пассивируются из-за образования плотных оксидных плёнок.
Азотная кислота окисляет многие неметаллы (обычно до кислородсодержащих кислот), а также соли, в состав которых входят ионы-восстановители:
S + 2HNO3 Þ H2SO4 + 2NO,
3Fe(NO3)2 + 4HNO3 Þ 3Fe(NO3)3 + NO + 2H2O,
3NiS + 8HNO3 Þ 3S + 3Ni(NO3)2 + 2NO + 4H2O.
Смесь концентрированных азотной и соляной кислот с объёмным соотношением 1:3 называется «царской водкой». В царской водке растворяются золото, платина, сульфид ртути(II) с образованием хлоридных комплексов:
Au + 3HNO3 + 4HCl Þ H[AuCl4] + 3NO + 6H2O.
В этой смеси кислот HNO3 выполняет функцию окислителя, а HCl - функцию комплексующего реагента. Комплексообразование существенно понижает окислительно-восстановительные потенциалы металлов и тем самым облегчает их окисление*:
E0 (Au3+/Au) = +1.52 B, E0 ([AuCl4]-/Au) =+ 1,00 B.
На том же принципе работает смесь конц. HNO3 с HF. Её применяют для растворения малоактивных d-металлов IV¸VI групп, Be, B и Si, имеющих высокое сродство к фтору:
3Si + 4HNO3 + 18HF Þ 3H2[SiF6] + 4NO + 8H2O.
Нитраты – соли азотной кислоты или N2O5, известны почти для всех металлов и существуют в виде безводных соединений (NaNO3, AgNO3), а также в виде кристаллогидратов (Ca(NO3)2×4H2O, Ni(NO3)2×6H2O). Нитраты щелочных, щелочноземельных металлов и аммония называют селитрами. Практически все соли азотной кислоты хорошо растворимы в воде.
В свободном состоянии фосфор в природе не встречается. Основными минералами фосфора являются фосфорит - Ca3(PO4)2 и апатиты - Ca5(PO4)3X, где Х= F, Cl, OH. Фосфор входит в состав животных организмов и составляет минеральную часть костных тканей, а его органические производные участвуют в процессах обмена веществ и накопления энергии.
Простое вещество. Фосфор существует в виде нескольких аллотропных модификаций, из них важнейшие – белый, красный и чёрный фосфор.
В обычных условиях все модификации фосфора энергично реагируют с галогенами:
2P + 5Cl2 Þ 2PCl5,
а при нагревании окисляются серой:
4P + 3S Þ P4S3
В последней реакции образуются также другие сульфиды с общей формулой - P4Sx, где х=3, 5, 7, 9, 10).
Кислотами-окислителями фосфор окисляется до ортофосфорной кислоты:
3P + 5HNO3 + 2H2O Þ 3H3PO4 + 5NO.
Растворы сильных окислителей взаимодействуют со всеми модификациями фосфора, например, в лаборатории остатки белого фосфора нейтрализуют перманганатом калия:
3P4 + 20KMnO4 + 8H2O Þ 20MnO2 + 8K2HPO4 + 4KH2PO4.
При взаимодействии с металлами фосфор способен выступать окислителем, образуя фосфиды:
2P + 3Ca Þ Ca3P2 (при нагревании).
Водородные соединения фосфора. Непосредственно с водородом фосфор не реагирует. Однако при растворении фосфора в щелочах (см. выше) или обработке фосфидов водой -
Ca3P2 + 6H2O Þ 3Ca(OH)2 + 2PH3,
выделяется очень ядовитый, с неприятным запахом бесцветный газ фосфин - РН3 (tкип.=-87,70С) с примесью дифосфина - Р2Н4.
Оксиды фосфора. Фосфор образует два устойчивых оксида Р2О3 и Р2О5. Они имеют ярко выраженный кислотный характер.
Кислоты фосфора. Фосфор образует целый ряд кислородсодержащих кислот, в которых формальные степени окисления изменяются от +1 до +5. Однако во всех кислотах фосфор пятивалентен.
Фосфористая кислота – Н2[HPO3] – бесцветное очень гигроскопичное кристаллическое вещество, хорошо растворяющееся в воде.
Ортофосфорная кислота Н3РО4 (обычно её называют просто фосфорной кислотой) - снегообразное, очень гигроскопичное вещество (tпл.=420С). В воде хорошо растворяется с большим выделением теплоты.
В отличие от многих других производных фосфора Н3РО4 не ядовита, но при попадании на кожу вызывает ожоги. Ортофосфорная кислота является электролитом средней силы (Кa1 =7,6×10-3, Кa2 =6,2×10-8, Кa3 =4,4×10-13) и образует средние соли (М3РО4) и два ряда кислых солей: М2НРО4 и МН2РО4
Простые вещества. Мышьяк, сурьма, висмут, как и фосфор, существуют в нескольких аллотропных модификациях. У мышьяка и сурьмы имеются неметаллические модификации – «жёлтый мышьяк» и «жёлтая сурьма», которые по строению подобны белому фосфору и состоят из молекул As4 и Sb4. Эти модификации неустойчивы и самопроизвольно превращаются соответственно в «серый мышьяк» и «серую сурьму», которые обладают металлическим блеском и электропроводностью. Слоистая структура, аналогичная чёрному фосфору, придаёт им значительную хрупкость. Так металлическая сурьма при растирании легко измельчается в порошок. У висмута существуют только металлические модификации. В обычных условиях висмут - хрупкий с красноватым оттенком металл. При температурах выше 1200С висмут приобретает ковкость и пластичность.
При комнатной температуре As, Sb и Bi реагируют только с галогенами, образуя тригалогениды, а в случае сурьмы - и пентагалогениды. При нагревании на воздухе они сгорают с образованием оксидов Э2О3, а с расплавленной серой дают сульфиды Э2S3. Все простые вещества с металлами образуют сплавы, а также стехиометрические и нестехиометрические соединения:
Ga + As Þ GaAs, 2Co + As Þ Co2As.
Имея стандартные окислительно-восстановительные потенциалы положительнее потенциала водорода, мышьяк, сурьма и висмут не растворяются в кислотах-неокислителях и не реагируют с растворами щелочей. Кислоты-окислители окисляют мышьяк и сурьму до мышьяковой и сурьмяной кислот:
3As + 5HNO3 + 2H2O Þ 3H3AsO4 + 5NO,
3Sb + 5HNO3 Þ 5NO + H2O + 3HSbO3 (b-сурьмяная кислота).
Висмут в концентрированной азотной кислоте пассивируется, но в разбавленной кислоте растворяется с образованием нитрата висмута (III):
Bi + 4HNO3 Þ Bi(NO3)3 + NO + 2H2O.
Металлические сурьма и висмут могут реагировать с концентрированной соляной кислотой в присутствии окислителя, например, пероксида водорода:
2Sb + 12HCl + 3H2O2 Þ 2H3[SbCl6] + 6H2O.
В природе мышьяк, сурьма и висмут находятся в виде сульфидных минералов: As2S3 – аурипигмент, As4S4 – реальгар, Sb2S3 – антимонит (сурьмяный блеск), Bi2S3 – висмутин (висмутовый блеск), FeAsS – арсенопирит и др.. Крайне редко эти элементы встречаются в самородном виде.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1877; Нарушение авторских прав?; Мы поможем в написании вашей работы!