
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Общая характеристика p-элементов 3 группы
|
|
|
|
Карбонилы металлов. Многие металлы непосредственно реагируют с оксидом углерода, если находятся в мелкодисперсном состоянии. Практически любой из переходных металлов образует карбонильные комплексы. Первые комплексные соединения карбонилов металлов Ni(CO)4 и Fe(CO)5 были открыты Мондом в 1890 и 1891 г.
И осадок отфильтровывают. Другой способ устранения жесткости заключается в пропускании воды через колонки с катионообменными смолами для извлечения из неё ионов кальция и магния.
Соединения углерода с галогенами. Углерод образует много соединений с галогенами. Непосредственно протекает реакция только со фтором:
С + 2F2 Þ CF4.
Тетрафторид углерода CF4 – очень инертный газ (tкип = -128 оС). Он не реагирует ни с кислотами, ни со щелочами. Поэтому его, как и другие фторсодержащие соединения, в частности, CF2Cl2 (tпл = -155оС, tкип = -30оС) используют в качестве фреонов – рабочих веществ в холодильных машинах. Большое практическое применение находят фторопласты, в частности тефлон используют для изготовления химически инертной посуды и аппаратуры. Тефлон получают полимеризацией тетрафторэтилена CF2 = CF2. На тефлон не действует кипящая HNO3 и расплавленная NaOH, он устойчив до 320 оС.
С другими галогенами углерод непосредственно не реагирует. Тетрахлорид углерода CCl4, негорючую жидкость, (tкип = 76 оС) получают хлорированием метана:
CH4 + 2Cl2 Þ CCl4 + 4HCl
CCl4 широко используется в качестве неполярного растворителя, в частности, для экстракции галогенов и других неполярных веществ из водных растворов.
Соединения углерода с серой. При высокой температуре (750¸1000 оС) углерод реагирует с серой:
С + 2S Þ CS2 ∆Но = +88,7 кДж/моль.
CS2 – дисульфид углерода (сероуглерод) представляет собой легко воспламеняющуюся жидкость (tкип = -46,2оC ). Пары её очень токсичны. Используется как растворитель.
Соединения углерода с азотом
Циановодород HCN представляет собой бесцветную легколетучую жидкость (tкип =26,5 оС) с запахом миндаля. Это один из сильнейших ядов. В жидком состоянии циановодород представляет смесь двух таутомерных форм – «нормальной» и изоформы:
Н-СºN («нормальная»): Û H-N=C (изоформа):
Таутомерия – динамическое равновесие между структурными изомерами. Высокую токсичность циановодорода связывают с изоформой, которая соединяется с окислительными ферментами клеток через атом углерода с неподеленной парой электронов (как и СО) и прекращает окислительные процессы в клетках, вызывая удушье и паралич дыхания.
В качестве противоядия по отношению к HCN используют глюкозу, которая содержит альдегидную группу.
Тиоциановая кислота HSCN – бесцветная очень неустойчивая маслянистая жидкость, с водой смешивается в любых соотношениях, образуя сильную (типа HCl) кислоту.
Тиоцианаты (роданиды) применяют при крашении тканей, NH4SCN используют в качественном анализе для обнаружения катионов Fe+3 и Со2+:
Fe3+ + 6SCN- Þ [Fe(SCN)6]3-; Co2+ + 4SCN- Û [Co(SCN)4]2-
При этом образуется комплексные соединения темно-красного и синего цвета соответственно.
Карбиды. С менее электроотрицательными элементами углерод образует карбиды. В качестве простейшего ковалентного карбида можно рассматривать метан СН4, в котором формально степень окисления углерода – 4, а водорода +1. Метан образуется при непосредственном взаимодействии углерода с водородом.
С + 2Н2 Þ СН4
Реакция протекает при высокой температуре в присутствии мелкораздробленного Ni катализатора. Метан – горючий газ без цвета, вкуса и запаха, мало растворим в воде и не реагирует с ней.
Метан, как и СО2, относится к «парниковым газам», способным поглощать длинноволновое тепловое излучение Земли. Повышение его концентрации в атмосфере также способствует глобальному потеплению, т.е. «парниковому эффекту».
Карбидами в широком смысле слова называют бинарные соединения углерода с более электроположительными элементами. Но обычно термин карбиды относят только к соединениям углерода с металлами, а также бором и кремнием. С металлами углерод образует карбиды различного состава: например, М2С2, МС2, М4С3 и др.
КРЕМНИЙ
Кремний - второй элемент по распространенности на Земле после кислорода. Масса земной коры (литосферы) более чем на четверть (27.6%) состоит из кремния. Известно более 400 минералов - это разнообразные силикатные породы, основу которых составляет диоксид кремния. Наиболее часто встречаются формы кремнезема (SiO2×nH2O) с различным содержанием воды. Академик А. Е. Ферсман писал: “Самые разнообразные предметы: прозрачный шар, сверкающий на солнце чистотой холодной ключевой воды; красивый, пестрого рисунка, агат; яркой игры многоцветный опал; чистый песок на берегу моря; тонкая, как шелковинка, нитка из плавленого кварца или жаропрочная посуда из него; красиво ограненные груды горного хрусталя; таинственный рисунок фантастической яшмы; наконечник стрелы древнего человека… - все это одно и то же химическое соединение элементов кремния и кислорода”.
Атом кремния в основном состоянии имеет два спаренных s- электрона, два неспаренных p-электрона, одну вакантную р-орбиталь и пять вакантных d-орбиталей. Электронно-графические формулы валентного слоя кремния в основном и валентно-возбужденном состояниях имеют следующий вид:

Благодаря своему электронному строению кремний может проявлять валентности II, IV и VI, и имеет характерные степени окисления в соединениях –4, +2, +4. Элемент может быть четырехвалентным за счет увеличения числа неспаренных электронов в валентно-возбужденном состоянии. Вакантные d-орбитали кремния определяют возможность образования связей по донорно-акцепторному механизму, что приводит к увеличению валентности и координационного числа до 6. Химия кремния лишь незначительно напоминает химию углерода. Так для кремния не характерно образование кратных связей Si=Si и SiºSi, что свойственно углероду, зато кремний легко образует комплексные фториды:
SiF4 + 2HF = H2[SiF6].
Элементарный кремний. Несмотря на распространенность в природе, этот элемент был открыт сравнительно поздно. В 1825 г. выдающийся шведский химик и минералог Йенс Якоб Берцелиус сумел выделить не очень чистый аморфный кремний в виде коричневого порошка при восстановлении газообразного тетрафторида кремния металлическим калием:
SiF4 + 4K Þ Si + 4KF.
Чистый кремний - кристаллическое сине-серое вещество с металлическим блеском, встречается в структурной форме, которая подобна алмазу (температура плавления 1415оС). При комнатной температуре кристаллический кремний обладает малой реакционной способностью и реагирует только со фтором:
Si + 2F2 Þ SiF4.
Взаимодействие с другими элементами, в том числе с кислородом и галогенами, протекает только при нагревании до 500-600оС:
Si + 2Cl2 Þ SiCl4
Образование диоксида SiO2 является экзотермической реакцией и сопровождается выделением значительного количества теплоты:
Si + O2 Þ SiO2 (кр.); H0 = -911 кДж/моль
Кремний при высоких температурах обладает большим сродством к кислороду и проявляет сильные восстановительные свойства (по отношению к кислородсодержащим соединениям). Например:
2H2O (г) + Si (кр) Þ SiO2 (кр) +2H2 (г).
При спекании смеси кремния с более электроположительными элементами, главным образом металлами, он выступает в роли окислителя и образует силициды:
2Mg + Si Þ Mg2Si.
Карбид кремния, карборунд (SiC), получают в результате реакции кварцевого песка SiO2 с углем, проходящей в электрической печи при температуре 2000оС:
SiO2 + 3C Þ SiC + 2CO.
Это соединение, как и многие карбиды, отличается механической прочностью, твердостью, химической стойкостью и жаропрочностью. По твердости кристаллы SiC уступают лишь алмазу и боразону (BN), но поскольку карбид кремния значительно дешевле, его широко применяют для обработки твердых материалов.
Нитрид кремния Si3N4 образуется при взаимодействии кремния c азотом или аммиаком при температуре выше 1300оС:
3Si + 2N2 Þ Si3N4
Это соединение обладает высокой термостойкостью и малой реакционной способностью (не реагирует с кислотами, щелочами, расплавами металлов и органическими растворителями), поэтому находит широкое применение в качестве материала для защитных покрытий.
С водными растворами кислот кремний не реагирует. Кислоты-окислители (HNO3 и H2SO4конц) пассивируют кремний, поскольку образующийся на поверхности слой диоксида кремния не растворяется в кислотах. Однако кремний реагирует со смесью азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF Þ 3H2[SiF6] + 4NO + 8H2O.
Образующийся октаэдрический комплекс - гексафторосиликат-ион является очень прочным соединением.
В растворах щелочей кремний растворяется довольно легко даже при рН 8-9 (слабощелочная среда). В этих условиях реакция идет с образованием SiO2, а ионы ОН- играют роль катализатора, препятствующего образованию плотной пленки на поверхности
|
В более концентрированных растворах щелочей при рН 11-14 реакция протекает с образованием силикатов - солей метакремниевой кислоты:
H2O + Si + 2NaOH Þ Na2SiO3 + 2H2
Гидриды кремния (силаны). Простейшей формой существования водородных соединений элементов IV-А подгруппы является ЭН4. Если для углерода соединение СH4 очень прочное, то при движении по группе сверху вниз от углерода к свинцу увеличение размеров орбиталей приводит к уменьшению прочности связи элемента с водородом и, начиная с кремния, гидриды становятся неустойчивыми. Простейшие водородные соединения элементов IV-А подгруппы - это газообразные вещества, плохо растворимые в воде.
В то время как для углерода существуют гомологи метана общей формулы СnH2n+2 без ограничения числа n, гидриды кремния образуют ограниченный ряд от SiH4 до Si8H18, что связано с уменьшением прочности связи элемент-элемент. Легкость термического разложения силанов возрастает с ростом числа звеньев. Высшие силаны менее уcтойчивы, чем SiH4 и Si2H6.
Соединения с галогенами. Кремний образует ряд галогенидов. Известны галогениды состава: SiX4, Si2X6, Si3X8, Si4X10, Si10X22, Si25X52 и высокомолекулярные (SiX2)n (X: F, Cl, Br, I).
При комнатной температуре SiF4 – газ, SiCl4 и SiBr4 – жидкости, SiI4 – твердое вещество. Все они бесцветны и являются типичными галогенангидридами.
Оксиды кремния. Элементы IV группы главной подгруппы образуют два ряда оксидов, в которых их степени окисления равны +2 и +4.
Монооксид кремния SiO получают восстановлением диоксида SiO2 углем, водородом или элементарным кремнием при температуре 1300-1500 оС:
SiO2 + C = CO + SiO (газ)
Газообразный SiO неустойчив, его термодинамическая стабильность возрастает при повышении температуры (аналогично монооксиду углерода СО).
Диоксид кремния SiO2 встречается в нескольких кристаллических модификациях - кварц, тридимит, кристобалит и др., отличающихся температурами плавления и кристаллографическими характеристиками, переход между которыми осуществляется при повышении температуры.
Диоксид кремния SiO2 – кислотный оксид, но его реакционная способность крайне низка. Он не подвергаются воздействию хлора, брома, водорода, инертен по отношению к большинству кислот и металлов даже при повышенной температуре. Как и любой высший оксид, SiO2 формально является окислителем, но исключительно слабым. Он может быть восстановлен только при высоких температурах сильным восстановителем, например, металлическим калием или углеродом. Диоксид кремния реагирует при обычных условиях только с фтором (давая SiF4) и фтороводородной кислотой:
SiO2 + 6HF Þ H2SiF6 + 2H2O
Если требуется получить матовый рисунок на стекле, то его обрабатывают (травят) плавиковой кислотой, предварительно покрыв парафином те места, которые должны остаться блестящими.
Кремниевые кислоты и их соли. Гидроксиды кремния не образуются при непосредственном взаимодействии SiO2 с H2O. Однако при подкислении водных растворов силикатов (например, Na2SiO3) или гидролизе некоторых бинарных соединений кремния (IV) (например, SiCl4), образуется гидратированный диоксид кремния m SiO2· n H2O, выпадающий в осадок.
Соли кремниевых кислот называются силикатами.
Строение силикатов. В ортосиликатах ион SiO44- имеет строение правильного тетраэдра, как, например, в минералах циркон Zr[SiO4], гранат Ca3Al2[SiO4]3. Минерал берилл Be3Al2(Si6O18), хризолит [Mg6(OH)6][Si4O11]×H2O. В качестве примера силикатов со слоистой (листовой) структурой приведем: тальк [Mg3(OH)2] × [Si4O10].
ГЕРМАНИЙ, ОЛОВО И СВИНЕЦ
Простые вещества. Все металлы IV группы главной подгруппы – белые, блестящие вещества (за исключением a-Sn)с плотностью выше 5 г/см3. Олово и свинец – мягкие, низкоплавкие и хорошо проводящие электрический ток металлы.
Германий, имея кристаллическую решетку как у алмаза, обладает необычно высокой для металлов твёрдостью (6,3 по шкале Мооса), высокой температурой плавления (9580С) и проявляет полупроводниковые свойства.
Олово существует в виде трёх аллотропных модификаций – серого олова (a-Sn), белого олова (b-Sn) и g-Sn. Белое олово устойчиво при температурах выше 13,20С, имеет невысокую твёрдость и, наоборот, высокую пластичность. Прокаткой удаётся получать очень тонкую фольгу (толщиной до 2,5 мкм), которую называют станиолью. Электропроводность белого олова составляет 14% от электропроводности серебра. Серое олово – серый порошок без металлического блеска устойчивый при температурах ниже 13,20С. Эта модификация имеет кристаллическую структуру подобную алмазу и является полупроводником, как кремний и германий.
Свинец имеет голубовато-серый цвет и блестит, однако на воздухе быстро тускнеет. Это самый мягкий среди тяжёлых металлов – он оставляет след на бумаге и режется ножом. Теплопроводность и электропроводность свинца невелики. При 7,5 К, он становится сверхпроводником. Металлический свинец хорошо поглощает a-, b- и жёсткое электромагнитное излучение.
При комнатной температуре все три металла устойчивы к кислороду (свинец покрывается тонкой оксидной плёнкой и теряет блеск). При нагревании они окисляются кислородом (образуя GeO2, SnO2 и PbO), галогенами (GeX4, SnX4, PbX2) и серой (GeS или GeS2, SnS или SnS2 и PbS). Водород, углерод и азот на германий, олово и свинец не действуют.
Стандартные окислительно-восстановительные потенциалы переходов
М2+ + 2е- Û М0 у олова и свинца немного отрицательнее потенциала водорода, а у германия - больше потенциала водорода (см. таблицу 1), поэтому олово и свинец могут растворяться в таких кислотах как HCl и разбавленной H2SO4, а германий нет. Компактное олово медленно растворяется в разбавленных соляной и серной кислотах. Свинец в этих кислотах пассивируется из-за образования на его поверхности плёнок малорастворимых PbCl2 и PbSO4. В уксусной кислоте свинец медленно растворяется, т.к. продукт растворения – ацетат свинца(II) – хорошо растворимая соль. Концентрированные галогенводородные кислоты растворяют малорастворимые галогениды свинца с образованием комплексов:
Pb + 4HClконц. Þ H2[PbCl4] + H2
Комплексообразование в концентрированных растворах кислот способствует также и растворению олова:
Sn + 3HClконц. Þ H[SnCl3] + H2.
В присутствии окислителей (Cl2, Br2, H2O2, NaClO, O2) все три металла реагируют с кислотами и растворами щелочей:
Ge + 4HClконц + 2H2O2 Þ GeCl4 + 4H2O (с примесью H2[GeCl6])
Sn + 6HClконц+ 2H2O2 Þ H2[SnCl6] + 2H2O
Pb + 4HClконц + H2O2 Þ H2[PbCl4] + 2H2O
Ge + 2NaOH + 2H2O2 Þ Na2 [Ge(OH)6]
Sn + 2NaOH + 2H2O2 Þ Na2[Sn(OH)6]
Pb + 2NaOH + H2O2 Þ Na2[Pb(OH)4].
Они реагируют с концентрированными азотной и серной кислотами:
Ge + 4HNO3 конц Þ H2GeO3 + 4NO2 + H2O
Sn + 4HNO3 конц Þ b-H2SnO3¯ + 4NO2 + H2O
Pb + 4HNO3 конц Þ Pb(NO3)2 + 2NO2 + 2H2O (при нагревании),
Ge + 2H2SO4 концÞ H2GeO3 + 2SO2 + H2O
Sn + 4H2SO4 концÞ [Sn(SO4)2(H2O)2 ] + 2SO2 + 2H2O
Pb + 5H2SO4 концÞ H2[Pb(SO4)2] + SO2 + 2H2O,
но лучше всего растворяются в царской водке:
3Ge +12HCl конц+4HNO3 конц Þ 3GeCl4 + 4NO + 8H2O (c примесью H2[GeCl6])
3Sn + 18HCl конц+ 4HNO3 концÞ 3H2[SnCl6] + 4NO + 8H2O
3Pb + 12HCl конц + 2HNO3 конц Þ 3H2[PbCl4] + 2NO + 4H2O
В указанных реакциях германий и олово образуют соединения в степени окисления +4, а свинец – в степени окисления +2.
Следует отметить, что в отличие от германия, олово и свинец взаимодействуют с водным раствором щелочи и в отсутствии окислителей:
Sn + 2NaOH + 2H2O Þ Na2[Sn(OH)4] + H2 (в инертной атмосфере),
Pb + 2NaOH + 2H2O Þ Na2[Pb(OH)4] + H2.
На холоду в разбавленной азотной кислоте олово подобно свинцу окисляется до степени окисления +2:
4Sn + 10HNO3 Þ 4Sn(NO3)2 + NH4NO3 + 3H2O (t = 00С).
В присутствии кислорода свинец и олово реагируют даже с органическими кислотами:
2Pb + 4CH3COOH + O2 Þ 2Pb(CH3COO)2 + 2H2O,
В отсутствии кислорода олово пассивируется органическими кислотами, поэтому для длительного хранения консервируемых продуктов широко используются банки из луженой стали. После вскрытия банки хранить продукт в ней больше нельзя, т.к. можно отравиться образующимися солями олова, которые, в отличие от металлического олова, токсичны.
Оксиды. Все три элемента образуют характерные для них оксиды состава МО и МО2. Для олова и свинца существует ряд смешанных оксидов, включающих одновременно атомы М+2 и М+4 (например, Pb3O4, Pb2O3, Sn3O4). Все оксиды имеют амфотерный характер, однако у GeO2 преобладают кислотные свойства, а у PbO – основные свойства. PbO2, Pb2O3 и Pb3O4 являются сильными окислителеми, а GeO и SnO проявляют сильные восстановительные свойства.
Все диоксиды восстанавливаются углеродом до металла:
МО2 + 2С Þ М + 2СО (при нагревании).
Гидроксиды и их соли. Гидроксиды германия(IV), олова(IV) и свинца(IV) имеют амфотерный характер и представляют собой гидратированные диоксиды хМО2×уН2О.
Германиевые кислоты в отличие от кремниевых кислот более растворимы в воде, но подобно xSiO2×yH2O, образуют коллоидные растворы. В водном растворе GeO2 присутствуют молекулы и ионы метагерманиевой кислоты H2GeO3 (Кa1=10–9) и продукты полимеризации – ионы пентагерманиевой и гептагерманиевой кислот:
H2GeO3 «HGeO3– «Ge5O112– «H2Ge7O162–
С увеличением концентрации германия и с повышением рН раствора равновесие сдвигается в сторону высокополимеризованных форм. При рН>11 в растворах существуют ионы гидроксокомплексов [Ge(OH)6]2–, а при рН=0¸2 и катионы германия(IV).
Соли германиевых кислот – германаты.
Оловянные кислоты. При взаимодействии тетрахлорида олова с растворами щелочей, аммиака или при действии кислот на растворы станнатов щелочных металлов образуется a-оловянная кислота – SnO2×xH2O - «белый гель», которому обычно приписывают формулу H4SnO4 (ортооловянной кислоты). При нагревании или длительном стоянии раствора протекает реакция поликонденсации, приводящая к образованию полимерной b-оловянной кислоты – (H2SnO3)n.
Соли оловянных кислот состава Me2ISnO3 – метастаннаты получают сплавлением диоксида олова со щелочами:
SnO2 + 2 NaOH Þ Na2SnO3 + H2O.
Кроме метастаннатов и гексагидроксостаннатов известны и ортостаннаты, например, Mg2SnO4 или Zn2SnO4.
Свинцовые кислоты xPbO2×yH2O неизвестны. Однако существуют многочисленные соли свинца(IV): метаплюмбаты, ортоплюмбаты и гексагидроксоплюмбаты. Метаплюмбаты: Me2IPbO3 и MeIIPbO3 (где MeI=Na+, K+, Ag+, MeII= Ca2+, Zn2+, Cu2+, Pb2+ и т.д.)
Гидроксид германия(II) - Ge(OH)2 образуется в виде красно-оранжевого осадка при обработке солей германия(II) щелочами:
GeCl2 + 2NaOH Þ ¯Ge(OH)2 + 2NaCl.
Гидроксид имеет амфотерные свойства:
Ge(OH)2 + 2KOHконц. Þ K2[Ge(OH)4],
Ge(OH)2 + 2HCl Þ GeCl2 + 2H2O,
и является сильным восстановителем.
Гидроксид олова(II) - Sn(OH)2 можно получить только в неводных растворителях обменной реакцией из оловоорганических соединений:
2(H3C)SnOH + SnCl2 Þ Sn(OH)2 ¯ + 2(H3C)SnCl.
Гидроксид олова(II) амфотерный. При растворении в щелочах образует гидроксокомплексы, например:
Sn(OH)2 + NaOH Þ Na[Sn(OH)3].
Соли олова(II) являются хорошими восстановителями, как в кислой, так и щелочной среде:  E0(Sn4+/Sn2+)=+0,15 B, E0(Sn(OH)62–/Sn(OH)42–=–0,93 B. Они восстанавливают соединения золота(I), золота(III), мышьяка, ртути, железа(III), дихроматы, ванадаты, концентрированную азотную кислоту, молибденовую кислоту и др.
E0(Sn4+/Sn2+)=+0,15 B, E0(Sn(OH)62–/Sn(OH)42–=–0,93 B. Они восстанавливают соединения золота(I), золота(III), мышьяка, ртути, железа(III), дихроматы, ванадаты, концентрированную азотную кислоту, молибденовую кислоту и др.
Гидроксид свинца(II) - Pb(OH)2 – белое вещество, плохо растворимое в воде и аммиаке, обладает амфотерными свойствами:
Pb(OH)2 + 2HNO3 Þ Pb(NO3)2 + 2H2O,
Pb(OH)2 + 2KOH Þ K2[Pb(OH)4] (при рН³13),
Pb(OH)2 + 4HClконц.Þ H2[PbCl4].
Большинство солей Pb2+ малорастворимы. Из них наиболее значимы PbSO4 (белый кристаллический порошок, растворимый в горячей воде), PbI2 (жёлтые кристаллы, растворимые в горячей воде), PbCO3, Pb3(OH)2(CO3)2 (основной карбонат свинца или свинцовые белила). Реакция образования жёлтого осадка PbI2 при действии на растворы, содержащие ионы Pb2+, иодида калия используется, как аналитическая реакция.
К р-элементам III группы периодической системы Д. И. Менделеева относятся: бор В, алюминий Аl, галлий Ga, индий In и таллий Тl. Электронная конфигурация атомов ns2np1.
Ниже сопоставлены некоторые константы, характеризующие свойства атомов p-элементов рассматриваемой группы и соответствующих металлических веществ:
| B | Аl | Ga | In | Tl | |
| Радиус атома, нм | 0,091 | 0,143 | 0,139 | 0,166 | 0,171 |
| Энергия ионизации Э0→Э+, эВ | 8,3 | 5,98 | 6,0 | 5,8 | 6,1 |
| Радиус иона Э3+, нм | 0,020 | 0,057 | 0,062 | 0,092 | 0,105 |
| Плотность, г/см3 | — | 2,7 | 5,9 | 7,4 | 11,85 |
| Температура плавления, °С | 29,8 | 156,4 | |||
| Стандартный электродный потенциал Э3+/Э, В | — | -1,66 | -0,53 | -0,34 | + 0,72 |
На свойствах р-элементов III группы сказывается d-сжатие (Аl располагается в периодической системе в малом III периоде, a Ga, In и Тl в больших периодах непосредственно после d-элементов). Так, от Аl к Ga атомный радиус несколько уменьшается, а первый ионизационный потенциал возрастает. На свойствах атомов таллия, кроме того, сказывается и f-сжатие. Именно поэтому радиус атома Тl близок радиусу атома In, а энергия ионизации несколько выше.
Бор. В соответствии с электронной структурой атома (1s22s22p1) бор может быть одновалентным (один неспаренный электрон на энергетическом 2р-подуровне). Однако для бора наиболее характерны соединения, в которых он трехвалентен (при возбуждении атома три неспаренных электрона в энергетических 2s- и 2р-подуровнях).
Свободная 2р-орбиталь в возбужденном атоме бора обусловливает акцепторные свойства многих его соединений, в которых три ковалентные связи образованы по обменному кова-лентному механизму (например, ВВг3). Эти соединения склонны к присоединению частиц с электронно-донорными свойствами, т. е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму. Например:
BBr3 + Br- = [ВВr4]-
Известны два изотопа бора: 105В (19,6%) и 115B (80,4%). Ядра атомов изотопа (105В) легко поглощают нейтроны:
105В + 10n = 42He + 75Li
Способность бора поглощать нейтроны обусловливает его применение в ядерной энергетике: из борсодержащих материалов делают регулирующие стержни ядерных реакторов.
Кристаллы бора черного цвета; они тугоплавки (т. пл. 2300 °С), диамагнитны, обладают полупроводниковыми свойствами (ширина запрещенной зоны ΔE=1,55 эВ). Электрическая проводимость бора, как и других металлов, мала и несколько возрастает при повышении температуры.
При комнатной температуре бор химически инертен и взаимодействует непосредственно только с фтором; при нагревании бор окисляется хлором, кислородом и некоторыми другими неметаллами. Например:
4В + 3O2 = 2В2O3
2В + ЗСl2 = 2ВСl3
В соединениях с неметаллами степень окисления бора +3; все эти соединения ковалентны.
Триоксид бора В2O3 — кристаллическое вещество (т. пл. 450 °С, т. кип. 2250 °С), характеризующееся высокими значениями энтальпии и энергии Гиббса образования. При взаимодействии с водой В2O3 переходит в борную кислоту:
В2O3 + ЗН2O = 2Н3ВO3
Н3ВО3 — очень слабая (Kд ≈ 10-9) одноосновная кислота. Электролитическая диссоциация Н3ВО3 с отщеплением только одного иона Н+ объясняется уже описанными ранее акцепторными свойствами бора: свободная 2р-орбиталь атома бора предоставляется электронному донору ОН-, образующемуся при диссоциации молекул Н2O. Процесс протекает по схеме
Н3ВО3 + Н2O = Н[В(ОН)4] = Н+ + [В(ОН)4]-
Комплексный анион [В(ОН)4]- имеет тетраэдрическую структуру (sp3-гибридизация электронных орбиталей). Акцепторные свойства бора в соединениях со степенью окисления + 3 проявляются и в химии его галогенидов. Так, например, легко осуществимы реакции
BF3 + F- = [BF4]-
BF3 + NH3 = [F3BNH3]
в которых химическая связь между BF и F- или NH3 образуется по донорно-акцепторному механизму. Свойство галогенидов бора быть акцепторами электронов обусловливает их широкое применение как катализаторов в реакциях синтеза органических соединений.
Непосредственно с водородом бор не взаимодействует, а с металлами образует бор иды — обычно нестехиометрические соединения Ме4В, Ме2В, МеВ, Ме3В4, МеВ2 и МеВ6.
Гидриды бора (бораны) очень ядовиты и имеют весьма неприятный запах. Их получают косвенным путем, чаще всего при взаимодействии химически активных боридов с кислотами или галогенидов бора с гидридами щелочных металлов:
6MgB2 + 12НСl = Н2 + 8В + В4Н10 + 6MgCl2
8BF3 + 6LiH = В2Н6 + 6LiBF4
Простейшее соединение бора с водородом ВН3 в обычных условиях не существует, в связи с координационной ненасыщенностью частицы ВНз, вследствие чего происходит объединение двух таких частиц в молекулу диборана: 2ВНз = В2Н6 (ΔG0298 = -127 кДж/моль). Известны и другие бораны, которые можно представить двумя рядами BnHn+4 и BnHn+6.
Алюминий. Электронная конфигурация атома алюминия выражается формулой 1s22s22p63s23p1. На внешнем электронном слое атома есть один неспаренный электрон:
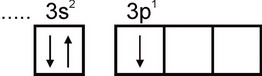
Поэтому алюминий может проявлять валентность, равную единице. Однако эта валентность для алюминия не характерна. Во всех устойчивых соединениях степень окисления алюминия равна +3. Валентность, равная трем, отвечает возбужденному состоянию атома Аl:
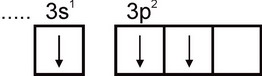
По своей распространенности алюминий занимает четвертое место среди всех элементов (после О, Н и Si) и является самым распространенным в природе металлом. Основная масса алюминия сосредоточена в алюмосиликатах: полевых шпатах, слюдах и др.
Алюминий — серебристо-белый легкий и чрезвычайно пластичный металл, обладающий высокой теплопроводностью и электрической проводимостью.
Алюминий химически активен; с хлором и бромом он реагирует при комнатной температуре, а с иодом — при нагревании или в присутствии воды как катализатора. При 800 °С алюминий взаимодействует с азотом, а при 2000 °С — с углеродом. Алюминий проявляет высокое химическое сродство к кислороду (ΔG0298 = -1582 кДж/моль):
2Аl + 0,502 = Аl2O3, ΔH0298 = -1650 кДж/моль
На воздухе алюминий покрывается очень прочной тончайшей (10-8 м) оксидной пленкой, которая несколько ослабляет металлический блеск алюминия. Благодаря оксидной пленке поверхность алюминия приобретает высокую коррозионную стойкость. Это прежде всего проявляется в индифферентности алюминия к воде и водяному пару. Вследствие образования защитной пленки алюминий устойчив по отношению к концентрированным азотной и серной кислотам. Эти кислоты на холоду пассивируют алюминий. Склонность к пассивированию позволяет повышать коррозионную стойкость алюминия путем обработки его поверхности сильными окислителями (например, К2Сr2О7) или с помощью анодного окисления. При этом толщина оксидной пленки возрастает до 3·10-5 м. При высоких температурах прочность защитной пленки резко снижается. Если механическим воздействием снять оксидную пленку, алюминий становится крайне реакционноспособным. Он энергично взаимодействует с водой и водными растворами кислот и щелочей, вытесняя водород и образуя катионы или анионы. Взаимодействие алюминия с растворами кислот протекает по уравнению реакции
Аl + 6Н2O + ЗН+ = [Аl(Н2O)6]3+ + 0,5Н2
а с растворами щелочей
Аl + ЗН2O + ОН- = [Аl(ОН)4]- + 0,5Н2
Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой является α-Аl2O3. Эта модификация встречается в земной коре в виде минерала корунда, из которого готовят шлифовальные диски и наждачные порошки. Применение корунда в качестве абразивного материала основано на его высокой твердости, уступающей лишь твердости алмаза, карборунда SiC и боразона BN. Сплавлением Аl2O3 с Сг2O3 получают искусственные рубины. В последнее время искусственные рубины применяют в квантовых генераторах (лазерах).
Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Он имеет слоистую кристаллическую решетку. Каждый слой состоит из октаэдров Аl(ОН)6; между слоями действует водородная связь. Получаемый по обменной реакции гидроксид алюминия — студенистый белый осадок, хорошо растворимый в кислотах и щелочах. При стоянии осадок «стареет» и теряет свою химическую активность. При прокаливании гидроксид теряет воду и переходит в оксид Аl2O3.
Галлий, индий и таллий в виде простых веществ — легкоплавкие серебристо-белые металлы. Физические и химические свойства Ga, In и Тl заметно отличаются от свойств Аl, несмотря на сходство электронной структуры внешнего энергетического уровня атомов рассматриваемых элементов. Здесь, видимо, сказывается разница в электронной структуре предвнешнего энергетического уровня атомов Аl: (n-1)s2(n-1)p6 с одной стороны и атомов Ga, In и Тl — с другой: (n-1)s2(n-1)р6(n-1)d10.
Степень окисления галлия и индия в устойчивых соединениях равна +3. Для таллия более характерна степень окисления + 1. Cоединения таллия, в которых степень окисления металла равна +3, являются сильными окислителями.
Галлий имеет широкий температурный интервал существования жидкого состояния. Низкая температура плавления (около 30 °С), высокая температура кипения (2205 °С) позволяют применять жидкий галлий для изготовления манометров.
Индий равномерно отражает световые волны всех длин и поэтому используется в точном приборостроении для изготовления зеркал. Кроме того, In входит в состав некоторых легкоплавких сплавов.
Таллий также вводится в некоторые сплавы, главным образом это сплавы с оловом и свинцом (кислотоупорные, подшипниковые).
Оксиды Ga2O3, In2O3 и Тl2O3 в воде практически нерастворимы. Заметное усиление основных свойств в ряду Ga2O3 — In2O3 — Тl2O3 проявляется в возрастающей растворимости оксидов в кислотах.
Гидроксиды Ga(OH)3, In(OH)3, Тl(ОН)3 в воде так же нерастворимы, как и оксиды. Белый осадок Ga(OH)3 растворим в равной мере и в кислотах, и в щелочах, а красно-коричневый Тl(ОН)3 — только в кислотах.
* Существует мнение, что фактически окислителем в царской водке является не азотная кислота, а хлор, который образуется при при взаимодействии HNO3 и HCl:
2HNO3 + 6HCl Û 2NO + 3Cl2 + 4H2O.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2878; Нарушение авторских прав?; Мы поможем в написании вашей работы!