
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм реакции
|
|
|
|
SR in vivo (в организме) пероксидное окисление липидов (ПОЛ). Липиды – компоненты клеточных мембран. В результате ПОЛ: изменения в обмене веществ, образование канцерогенных соединений.
Механизм ПОЛ:
1) первоначальное образование R •


 Fe2+ + O2 + H Fe3+ + HO – O • X• свободные радикалы
Fe2+ + O2 + H Fe3+ + HO – O • X• свободные радикалы
 Fe2+ +R–O–OH Fe3+ + HO– + RO •
Fe2+ +R–O–OH Fe3+ + HO– + RO •
2) инициирование
 R: H + X • HX + R •
R: H + X • HX + R •
липид
3) рост цепи

 R • + O2 R–O–O •
R • + O2 R–O–O •
 R–O–O + R H R–O–O–H + R •
R–O–O + R H R–O–O–H + R •
4) обрыв цепи
 ROO • + • R R–O–OR
ROO • + • R R–O–OR
Механизм реакции электрофильного присоединения (АЕ)
In vitro: присоединение к алкенам Hal2, HHal, H2O.
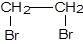 Бромирование этилена
Бромирование этилена
Пример 1. СН2=СН2 +Br2 →
1,2–дибромэтан
I стадия. Поляризация молекулы галогена по действием π-связи алкена
 σ δ+ δ–
σ δ+ δ–
Н2С = СН2 Br → Br
π
и образование электрофила Е+
 δ+ δ–
δ+ δ–
Br → Br → Br+ + Br –
гетеролиз Е+
II стадия. Образование π-комплекса за счет вакантной орбитали электрофила и пары электронов в π-связи
 СН2 СН2
СН2 СН2
Br+
 III стадия. Образование σ–комплекса (карбкатиона)
III стадия. Образование σ–комплекса (карбкатиона)
IV стадия. Присоединение Br – к карбкатиону, образование продукта реакции
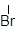
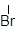
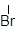 СН2 – СН2+ + Br – → CH2 – CH2
СН2 – СН2+ + Br – → CH2 – CH2
Присоединение HНal или H2O к несимметричным алкенам (R – CH=CH2)
идет по правилу Марковникова В.В.: Н присоединяется к наиболее, а Hal (или ОН–) к наименее гидрогенизированному атому С.
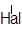 R–CH=CH2 + HHal → R–CH–CH3
R–CH=CH2 + HHal → R–CH–CH3
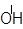 R–CH=CH2 + H–ОН → R–CH–CH3
R–CH=CH2 + H–ОН → R–CH–CH3
Пример 2. Присоединение бромоводорода к пропену
 Схема реакции:
Схема реакции:


 δ+ δ–
δ+ δ–

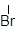 СН3 → СН=СН + Н+ → Br – → СН3–СН–СН3
СН3 → СН=СН + Н+ → Br – → СН3–СН–СН3
2–бромпропан
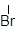 СН3: +I, ЭД, СН3–СН2–СН2
СН3: +I, ЭД, СН3–СН2–СН2
↑ē плотность,
АЕ к пропену идет легче, чем с СН2=СН2
Механизм реакции (АЕ):
I стадия: Гетеролиз связи в реагенте, образование электрофила (Е+).
 H → Br → H+ + Br –
H → Br → H+ + Br –
E+
II стадия: Образование π-комплекса за счет вакантной орбитали электрофила и пары электрона π-связи.
 δ+ δ–
δ+ δ–
 CH3 → CH CH2
CH3 → CH CH2
III стадия: Образование σ–комплекса (карбкатиона), причем новая σ–связь образуется между Е+ и атомом С с δ–.
 СН3 – СН+ – СН2
СН3 – СН+ – СН2
IV стадия: Присоединение Br – к карбкатиону, образование продукта реакции
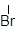 СН3 – СН+ – СН3 + Br – → CH3 – CH – CH3
СН3 – СН+ – СН3 + Br – → CH3 – CH – CH3
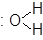
 Присоединение Н2О (гидратация) к алкенам идет с участием кислого катализатора (Н+ кислоты играет роль Е+).
Присоединение Н2О (гидратация) к алкенам идет с участием кислого катализатора (Н+ кислоты играет роль Е+).

 СН3–СН=СН2 + Н+ → СН3–СН СН2 → СН3 – СН+ – СН2 + →
СН3–СН=СН2 + Н+ → СН3–СН СН2 → СН3 – СН+ – СН2 + →
катализатор
Е+ π-комплекс σ–комплекс вода
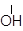
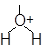 СН3 – СН – СН3 → СН3 – СН – СН3
СН3 – СН – СН3 → СН3 – СН – СН3
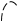 –Н+- регенерация
–Н+- регенерация
катализатора
ион оксония пропанол–2, конечный продукт реакции
АЕ in vivo: гидратация непредельных соединений, идет с участием биокатализаторов (ферментов).


 фермент
фермент



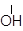 НООС – СН = СН – СООН + Н – ОН → НООС – СН2 – СН – СООН
НООС – СН = СН – СООН + Н – ОН → НООС – СН2 – СН – СООН
фумаровая кислота яблочная кислота
Механизм реакции электрофильного замещения (SЕ)
SЕ in vitro: галогенирование, нитрование, сульфирование, алкилирование, ацилирование ароматических соединений (бензола, его гомологов и производных).
I стадия: Генерирование электрофильной частицы.


 Е – Х → Еδ+ – Х δ– → Е+ + Х–
Е – Х → Еδ+ – Х δ– → Е+ + Х–
гетеролиз связи электрофил
 II стадия: Образование π-комплекса: вся система π-связей кольца взаимодействует с электрофилом.
II стадия: Образование π-комплекса: вся система π-связей кольца взаимодействует с электрофилом.


 III стадия: Образование σ–комплекса: электрофил вытягивает из 6 ē π-системы кольца 2 электрона и образует новую σ–связь с одним из атомов С кольца.
III стадия: Образование σ–комплекса: электрофил вытягивает из 6 ē π-системы кольца 2 электрона и образует новую σ–связь с одним из атомов С кольца.
+
в π-системе осталось 4 ē, ароматичность нарушена => σ–комплекс неустойчив.

 IV стадия: Восстановление ароматичности за счет выброса протона, образование продукта замещения.
IV стадия: Восстановление ароматичности за счет выброса протона, образование продукта замещения.
 |


 + – Н+
+ – Н+
Н+ + Х– = НХ
Таблица 1.
Образование электрофилов в реакциях SЕ.
 Название реакции Название реакции
| Вводимая группа | Генерирование электрофильной частицы |
 Галогенирование Галогенирование
| –Br, –Cl | Br – Br + FeBr3 → Br+ + FeBr – Cl – Cl + AlCl3 → Cl+ + AlCl4– |
 Нитрование Нитрование
| –NO2 | +H+ HO – NO2 → H2O + NO2+ азотная кислота |
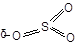 Сульфирование Сульфирование
| –SO3H | Серный ангидрид SO3 является Е+ благодаря поляризации связей |
 Алкилирование Алкилирование
| –CnH2n+1: –CH3, –C2H5, –C3H7 и т.д. | H3C – Cl + AlCl3 → H3C+ + AlCl4– |
     Ацилирование Ацилирование
| R–CO–: CH3–C–, C2H5–C– и т.д. | CH3–C – Cl + AlCl3 → CH3–C+ + AlCl4– |
Таблица 2.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 567; Нарушение авторских прав?; Мы поможем в написании вашей работы!