
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электронное влияние заместителей у к.ц
|
|
|
|
..
..
Основания (В) – способны присоединять протон (акцепторы Н+).
 Кислотность и основность – это относительные свойства.
Кислотность и основность – это относительные свойства.

 Н+А + В А– + ВН+
Н+А + В А– + ВН+
кислота основание сопряженные
основание кислота
I. Кислоты содержат кислотные центры (к.ц.) – это Н+ и связанный с ним атом.
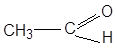
Типы к.ц. (кислот):
 СН – углеводороды: СН4 …, их производные …
СН – углеводороды: СН4 …, их производные …

 NH – амины R – NH 2, амиды карбоновых кислот
NH – амины R – NH 2, амиды карбоновых кислот
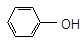 | |||
 | |||
 ОН – спирты R – OH, фенолы, карбоновые кислоты
ОН – спирты R – OH, фенолы, карбоновые кислоты
 |
SH – тиолы R – SH
Чем легче кислота отдает Н+, тем она сильнее.
Количественно сила кислот оценивается константой равновесия (Кравн.) = константой кислотности (Ка).

 СН3СООН СН3СОО– + Н+
СН3СООН СН3СОО– + Н+
[CH3COO–]·[H+]
 Ка = Кравн. =
Ка = Кравн. =
 [CH3COOH]
[CH3COOH]
pКа = –lgКа, рКа –показатель кислотности.
Чем сильнее кислота, тем больше Ка, а рКа меньше.
Сила кислот зависит от факторов:
1) электроотрицательность (ЭО) атома в к.ц.
ЭО ↑ (увеличивается)

ЭО C < N < O > S
к.ц. CH < NH < OH < SH
 кислотность ↑ (увеличивается)
кислотность ↑ (увеличивается)
по силе кислоты CH4 < CH3–NH2 < CH3–OH
рКа=40 рКа=35 рКа=16
2) поляризуемость атома в к.ц. ЭО О > S, но R атома, поляризуемость S > O.
к.ц. OH < SH
 устойчивость аниона ↑
устойчивость аниона ↑
 сила кислот ↑
сила кислот ↑
Чем более равномерное распределение отрицательного заряда – делокализация, тем более устойчивый анион.


 C2H5 OH C2H5O– + H+ C2H5 SH C2H5S– + H+
C2H5 OH C2H5O– + H+ C2H5 SH C2H5S– + H+
к.ц. этилат к.ц. этилтиолят
этанол анион этантиол анион
рКа=18 менее устойчив рКа=10,5 более устойчив
слабая кислота сильная кислота
Тиолы – более сильные кислоты, чем спирты.
Химические свойства:
2C2H5 OH + 2Na → 2C2H5ONa + H2 2C2H5 SH + 2Na → 2C2H5SNa + H2
соль соль
 этилат Na этантиолят Na
этилат Na этантиолят Na
C2H5 OH + NaOH → C2H5 SH + NaOH → C2H5SNa + H2O
слабая кислота
C2H5 ONa + H2O → C2H5OH + NaOH 2C2H5 SH + Hg2+O → (C2H5S)2Hg + H2O
pKa=15,7 pKa=18
Н2О С2Н5ОН
 Кислотные свойства позволяют применять тиолы (БАЛ, УНИТИОЛ) при отравлении соединениями тяжелых металлов (Hg2+, Pb2+, Cd2+…)
Кислотные свойства позволяют применять тиолы (БАЛ, УНИТИОЛ) при отравлении соединениями тяжелых металлов (Hg2+, Pb2+, Cd2+…)
 |
БАЛ УНИТИОЛ
 |  |


ЭД заместители => ↓ кислотности ЭА заместители => ↑ кислотности

 Пример 1.
Пример 1.
 фенол
фенол
 C2H5 → OH (карболовая
C2H5 → OH (карболовая
к.ц. кислота)
ЭД (+I) рКа=18 ЭА(–М) рКа=9,9
 |
кислотность ↑ (увеличивается)
Фенолы – более сильные кислоты, чем алифатические спирты.

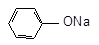 | |||
 | |||
 C2H5 OH + NaOH → 2 + 2Na → 2 + H2
C2H5 OH + NaOH → 2 + 2Na → 2 + H2
слабая кислота > сильная соль
кислота фенолят Na




+ NaOH → + H2O
 | |||
 | |||

 + HCl → + NaCl
+ HCl → + NaCl
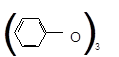


 Качественная реакция
Качественная реакция
на фенолы: 3 + Fe+3Cl3 → Fe + 3HCl
фенолят Fe
темно-фиолетовый
 |
Пример 2.

 C2H5 → OH ЭА (–I)
C2H5 → OH ЭА (–I)
к.ц.
ЭД (+I) рКа=18 рКа=15,1
этандиол–1,2 (этиленгликоль)

сила кислот ↑

 Многоатомные спирты (≥ 2ОН) – более сильные кислоты, чем одноатомные спирты.
Многоатомные спирты (≥ 2ОН) – более сильные кислоты, чем одноатомные спирты.
+ 2NaOH → + 2H2O
соль
этиленгликолят Na
 | |||
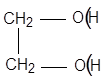 | |||
+ 2NaOH –2
 2 + Cu(OH)2 ↓ • 2Na+ + 4H2O
2 + Cu(OH)2 ↓ • 2Na+ + 4H2O
голубой
Качественная реакция этиленгликолят Cu
ярко-синий раствор
Пример 3.
 | |||||
 | |||||
 | |||||
 рКа=9,9 рКа=4,7
рКа=9,9 рКа=4,7

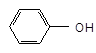



 + Н+ СН3СООН + Н+
+ Н+ СН3СООН + Н+



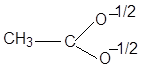 феноксид анион карбоксилат анион
феноксид анион карбоксилат анион

 устойчивость аниона ↑
устойчивость аниона ↑
 сила кислот ↑ более устойчивый анион
сила кислот ↑ более устойчивый анион
Карбоновые кислоты – более сильные кислоты, чем фенолы.
..
II. 



 Основания (В)
Основания (В)
π–основания n–основания
содержат = связь (алкены, арены…) содержат атом с неподеленной




 >C=C< + H+ → >C=C< π–комплексы парой ē (n) – основный центр (о.ц.)
>C=C< + H+ → >C=C< π–комплексы парой ē (n) – основный центр (о.ц.)

 H+ аммониевые сульфониевые оксониевые
H+ аммониевые сульфониевые оксониевые
......
+ H+ → → H+ >N–.. –S–.. –O–..
(амины R–NH2 (тиолы R–SH (спирты R–OH
Слабые нитрилы R–С≡N) тиоэфиры эфиры
.. R–S–R) R–O–R)
 В + Н+ ВН+
В + Н+ ВН+
основание сопряженная кислота
Количественной характеристикой силы оснований является рКвн+ (показатель кислотности сопряженной кислоты). Чем сильнее основание, тем больше рКвн+.
Сила основания определяется факторами:
1) ЭО и поляризуемость о.ц.
ЭО N < O поляризуемость O < S
Основность N > O > S
N – основания (амины) – самые сильные основания.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 322; Нарушение авторских прав?; Мы поможем в написании вашей работы!