
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Механизм электролитической диссоциации ионных и полярных соединений
|
|
|
|
Электролитическая диссоциация. Гидролиз солей.
Лекция 10
Основные понятия процесса электролитической диссоциации веществ в растворах были введены в практику С. Аррениусом в 1887г.
1.При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации):
КА ↔ К+ + А-
2.Под действием постоянного электрического тока катионы (+) двигаются к катоду (-), а анионы (-) – к аноду (+).
3.Электролитическая диссоциация – процесс обратимый.
4.Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (n0).
α = n / n0 0‹ α ‹ 1
По величине степени диссоциации вещества делят на сильные и слабые электролиты, а также неэлектролиты.
При растворении соединений с ионными связями (например, КС1) процесс сольватации начинается с ориентации диполей растворителя вокруг кристаллов соли.
Ориентируясь вокруг ионов кристаллической решетки, молекулы растворителя образуют с ними либо водородные, либо донорно-акцепторные связи. При этом выделяется большое количество энергии, которая называется энергией сольватации.
Энергия сольватации, величина сравнимая с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом сольватированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами образуют раствор. Причем в растворах сильных электролитов при повышении концентрации в результате ассоциации ионов могут образовываться ионные пары, тройки и т.д.
Аналогично подвергаются диссоциации и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, НС1), определенным образом ориентируются диполи растворителя. В результате взаимодействия с диполями растворителя полярная молекула еще больше поляризуется и превращается в молекулу с ионной связью, далее уже легко образуются свободные сольватированные ионы.
В растворах и расплавах электролиты диссоциируют на ионы, образование которых и объясняет ионную проводимость.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская молекулы растворителя, хотя они являются основными участниками процесса:
СаС12 = Са2+ + 2С1-
КОН = К+ + ОН-
HNO3 = H+ + NO3-
Из электронейтральности молекул вытекает, что суммарный заряд катионов и анионов должен быть равен 0.
Сильные электролиты – вещества, которые практически полностью распадаются в растворах на ионы. Как правило, к сильным электролитам относятся соединения с ионными или сильнополярными связями: все хорошо растворимые в воде соли, сильные кислоты (НС1, НВr, HI, HClO4, H2SO4, HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Ca(OH)2, Sr(OH)2). В растворе сильного электролита растворенное вещество находится, в основном, в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют.
Слабые электролиты – вещества, которые в растворах только частично диссоциируют на ионы. Поэтому растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Слабые электролиты не могут дать большой концентрации ионов в растворе.
К слабым электролитам относятся:
1) почти все органические кислоты и основания (например, СН3СООН, СН3NH2)
2) некоторые неорганические кислоты (Н2СО3, Н2S, HNO2, H2SO3 и др.)
3) гидроксид аммония NH4OH и вода
Они плохо или почти не проводят электрический ток и могут диссоциировать по ступеням. Процесс диссоциации слабого электролита обратим:
Н2СО3 ↔ Н+ + НСО3- (первая ступень)
НСО3- ↔ Н+ + СО32- (вторая ступень)
Концентрация ионов в растворах зависит от того, насколько полно данной электролит диссоциирует на ионы, что может быть полно охарактеризовано степенью и константой диссоциации.
Степень диссоциации зависит от концентрации раствора электролита. При разбавлении водой степень диссоциации увеличивается, так как увеличивается число молекул растворителя на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов, т.е. сольватированных ионов.
При увеличении температуры степень диссоциации растет, так как активируются связи в молекулах, они становятся более подвижными и легче ионизируются.
В растворах сильных электролитов, диссоциацию которых можно считать полной, концентрацию ионов легко определить по концентрации (С) и составу молекулы электролита (стехиометрическим коэффициентам), например:
С 2С С
H2SO4 = 2Н+ + SO42-
Однако в связи с тем, что в этих растворах увеличиваются силы межмолекулярного взаимодействия, вокруг каждого иона создается «ионная атмосфера» из противоположно заряженных ионов, поэтому определяемое разными методами значение степеней диссоциации сильных электролитов сильно отличается от теоретической величины и называется кажущейся степенью диссоциации. Поэтому было предложено сохранить для описания свойств растворов сильных электролитов все общие закономерности, применимые к идеальным растворам, но вместо входящих в них концентраций веществ ввести их активности.
Активность иона (а) равна произведению его концентрации на коэффициент активности (γ):
а = γ* С
В концентрированных растворах электролитов значение коэффициента активности γ‹‹ 1, что свидетельствует о взаимном влиянии ионов. С разбавлением раствора (концентрация менее 0,1моль/л) и уменьшении влияния ионов друг на друга величина γ приближается к 1.
Коэффициент активности вычисляют по экспериментальным данным. Для этого измеряют какое-либо свойство раствора (например, температуру кипения или замерзания) и определяют коэффициент активности как частное от деления экспериментальной и теоретической величин. Но этот метод позволяет определять только значения средних коэффициентов активности электролита. При необходимости расчета этих величин для отдельных ионов принимают, что средний коэффициент активности электролита представляет собой среднее геометрическое коэффициентов активности образующих его ионов. Так, для электролита АnBm
γ = n+m 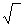 γn A m+ γmBn-
γn A m+ γmBn-
Коэффициенты активности изменяются в широких пределах и зависят от природы растворителя, растворенного вещества, концентрации раствора, а также от температуры. В области разбавленных растворов (менее 0,1моль/л) коэффициенты активности, главным образом, зависят от концентрации раствора и заряда ионов Z. Присутствующих в растворе, и мало зависят от природы растворенного вещества. Эта закономерность известна под названием правило ионной силы. Согласно этому правилу, ионы с одинаковым зарядом, независимо от их природы, в разбавленных растворах с одинаковой ионной силой имеют равные коэффициенты активности. Ионной силой (I) раствора называется полусумма произведений концентрации всех ионов раствора на квадрат их заряда:
I = 0,5 ∑ С i Z i
Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации и исходную концентрацию вещества в растворе.
Константа равновесия процесса электролитической диссоциации называется константой диссоциации (Кд) и выражается отношением произведения равновесных концентраций (для слабых электролитов) или активностей (для сильных электролитов) ионов в степенях, соответствующих стехиометрическим коэффициентам в уравнении диссоциации, к концентрации недиссоциированных молекул.
Она характеризует способность вещества распадаться на ионы: чем выше Кд, тем больше концентрация ионов в растворе.
Диссоциация слабых многоосновных кислот или многокислотных оснований протекает по ступеням. Соответственно для каждой ступени существует своя константа диссоциации. Например, для ортофосфорной кислоты (Н3РО4):
первая ступень: Н3РО4↔ Н+ + Н2РО4-
Кд1 = ([Н+]*[Н2РО4-]) / [Н3РО4] = 7,5 * 10-3
вторая ступень: Н2РО4-↔ Н+ + НРО42-
Кд2 = ([Н+]*[НРО42-]) / [Н2РО42-] = 6,31 * 10-8
третья ступень: НРО42- ↔ Н+ + РО43-
Кд3 = ([Н+]*[РО43-]) / [НРО4-] = 1,3 * 10-12
Константа диссоциации по первой ступени на много порядков выше остальных, так как энергия, затрачиваемая на отрыв одного иона от нейтральной молекулы, меньше, чем энергия отрыва иона от многозарядного иона на последующих стадиях диссоциации (Кд1>> Кд2>> Кд3).
По закону разбавления Оствальда степень электролитической диссоциации слабого электролита (α) связана с константой диссоциации (Кд).
Для слабой одноосновной кислоты НА:
НА ↔Н+ + А-
Кд = ([Н+] * [А-]) / ([НА]
Если общую концентрацию слабого электролита обозначить как с, то равновесные концентрации [Н+] и [А-] равны αс, а концентрация недиссоциированных молекул НА будет составлять (с – αс) = с (1 – а). Отсюда:
Кд = (ас * ас) / [ с (1 – а)] = а2 с / (1 – а).
В случае очень слабых электролитов (а << 0,01):
Кд = а2 с или а = 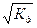 / с
/ с
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 824; Нарушение авторских прав?; Мы поможем в написании вашей работы!