
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Коррозия металлов. Меры защиты металлов от коррозии
|
|
|
|
Коррозия – это самопроизвольное разрушение металла в результате физико-химического воздействия окружающей среды, которое протекает с уменьшением энергии Гиббса системы.
По механизму коррозионных процессов в зависимости от свойств коррозионной среды различают два основных вида коррозии:
-1.Химическая коррозия, протекающая в средах, не проводящих электрический ток (газовая коррозия и коррозия в неэлектролитах);
-2.Электрохимическая коррозия, осуществляющаяся в средах с ионной проводимостью (анодное растворение металла и катодное восстановление окислителя).
При коррозии происходит гетерогенное окисление металла, сопровождаемое восстановлением одного или нескольких компонентов окружающей среды. Если среда неэлектропроводна, протекает химическая коррозия. Химическая коррозия состоит в воздействии газообразных окислителей (кислород, галогены) на металл или парообразных веществ под воздействием высоких температур в отсутствии влаги. Химическая коррозия также возникает при контакте металла с агрессивной органической жидкостью, неэлектролитом, которой, например, является нефть.
При коррозии металла в атмосфере кислорода уравнение реакции в общем виде можно записать так:
nMe + m/2O2 = MenOm
Процесс может протекать при условии, если энергия Гиббса меньше нуля: ∆G < 0. Энергия Гиббса простого вещества - кислорода, по определению равна нулю, поэтому ∆G реакции рассчитывают по уравнению:
∆G = ∆G0 - 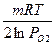
где ∆G0 – стандартная энергия Гиббса реакции (приводится в справочниках)
РО2 – относительное парциальное давление кислорода
Для большинства металлов стандартная энергия Гиббса их окисления меньше нуля, что говорит о возможности протекания коррозии металлов. Величина ∆G > 0, при которой коррозия невозможна, может быть при очень низком давлении О2, что практически нереально. Термодинамический расчет указывает на возможное направление процесса, но не на его скорость.
В процессе окисления металла или сплава на его поверхности образуется оксидная пленка (окалина), мешающая диффузному процессу проникновения кислорода к металлу. Через окалину диффундирует окислитель (О2), а в противоположном направлении через окалину одновременно протекает диффузия ионов металла к поверхности. Атомы кислорода в пленке ионизируются: О + 2е- = О2- и с ионами металла (Ме – ne- → Men+) образует оксиды, располагающиеся на поверхности металла по типу пленки. Прирост толщины окалины зависит от времени и температуры. Скорость коррозии возрастает с увеличением температуры из-за повышения коэффициента диффузии и изменения защитных свойств окалины.
Если диффузия компонентов сквозь окалину затруднена, то первичные слои окалины (оксиды металлов) оказывают защитное действие против дальнейшей газовой коррозии (пассивирование металлов). Скорость окисления металла оценивают по величине роста пленки δ во времени τ: δ = к ∙ lnτ
Для ряда металлов установлена логарифмическая зависимость роста образования пленки (Al, Zn, Cr). Процесс коррозии при увеличении толщины пленки замедляется, поскольку замедляется процесс диффузии реагентов через пленку.
Процессы, аналогичные газовой коррозии, происходят при термохимической обработке металлов в газовых средах, которую используют, в частности, для получения поверхностных слоев (пленок). Такой слой должен иметь оптимальную толщину, чтобы тормозить диффузию агрессивного реагента и встречную диффузию ионов металла, должен быть эластичным, иметь хорошую адгезию к металлу и иметь с ним одинаковый коэффициент линейного расширения.
Электрохимическая коррозия состоит из двух процессов: анодного и катодного. При анодном процессе атомы металла становятся ионами и переходят непосредственно в раствор. При катодном процессе остающиеся в металле избыточные электроны присоединяются к какому-либо акцептору или деполяризатору. Этот процесс подобен процессам, протекающим в гальванических элементах, но при электрохимической коррозии отсутствует внешняя цепь; электроны остаются в корродирующем металле; реакция протекает с выделением теплоты (не передается в виде работы).
Электрохимическая коррозия как самопроизвольный процесс протекает, если энергия Гиббса ∆G < 0. При действии электрического тока
∆G = -n ∙ F ∙ E
где n – валентность иона или число электронов, переходящих от окислителя к восстановителю
Е – электродвижущая сила.
Электродвижущая сила равна разности потенциалов окислителя и восстановителя. Коррозия возможна при условии, что потенциал окислителя (Еок) положительнее потенциала восстановителя (Евосст): Еок > Евосст
Примеры анодных процессов:
Fe – 2e- = Fe2+
Cd + H2O - 2e- = Cd(OH)2 + 2H+
Примеры катодных процессов:
2Н+ + 2е- = Н2 в кислой среде
О2 + 4Н+ + 4е- = 2Н2О в нейтральной среде или щелочной среде
О2 + 2Н2О + 4е- = 4ОН-
Реакции катодного восстановления О2 часто бывают лимитирующей стадией коррозии. В водных средах выделение Н2 протекает при более отрицательных потенциалах, чем равновесный потенциал водородного электрода (электродная поляризация). Если потенциал металла положительнее потенциала кислородного электрода, то коррозия металла невозможна. Коррозия металла возможна с поглощением кислорода и невозможна с выделением водорода, если потенциал металла положительнее потенциала водородного электрода и отрцательнее потнециала кислородного электрода. Скорость коррозии металлов может лимитироваться скоростью катодного или анодного процессов. Во втором случае важнейшим фактором является пассивность металла, что резко тормозит коррозию.
Пассивность металла проявляется в заторможенности взаимодействия металла со средой, обусловленная действием так называемых пассиваторов – агрессивных реагентов, хемосорбирующихся на поверхности металла и образующих с ним твердофазные химические соединения. Это препятствует растворению металлов и их окислению. Различают оксидную, солевую и другие пассивации металлов. Наиболее важна оксидная пассивация металлов, поскольку самый распространенный пассиватор – кислород.
Оксидный барьер устойчив в сухом негорячем воздухе, но в присутствии воды атомы металла могут образовывать помимо пассивирующих оксидов растворимые катионы. Тогда пассивации либо не наступает, либо она нарушается. В этом случае коррозия протекает тем быстрее, чем выше его электродный потенциал.
Пассивации металлов способствует легирование более легко пассивирующимся химическим элементом, повышение электродного потенциала, увеличение концентрации вблизи поверхности металла. Пассиваторами в воде могут быть окислители, анионы труднорастворимой соли данного металла. Но сами по себе окислители могут восстанавливаться, чем ускорят процесс коррозии металла.
Возможность коррозии определяет разность потенциалов металла и окислителя. Лимитирующими стадиями являются или анодное окисление металла или катодное восстановление окислителя.
Рассмотрим пример электрохимической коррозии железа, содержащего в качестве примеси медь в нейтральной и кислой среде.
а) нейтральная среда (влажный воздух):
(А) Fe (E0Fe2+/ Fe = -0.44B) │ H2O, O2 │ Cu (E0Cu2+/ Cu = +0.34B) (K)
(A) Fe – 2e- = Fe2+ окисление
(К) 2H2O + O2 + 4е- = 4ОН- восстановление
В молекулярной форме: 2 Fe + 2 H2O + O2 = 2 Fe(ОН)2
Далее Fe(ОН)2 подвергается воздействию влаги и кислорода воздуха:
4Fe(ОН)2 + 2H2O + O2 = 4Fe(ОН)3
Образовавшийся гидроксид железа переходит затем в Fe2O3 ∙ 3H2O или FeOOH (ржавчина).
б) кислая среда:
(А) Fe (E0Fe2+/ Fe = -0.44B) │ HСl │ Cu (E0Cu2+/ Cu = +0.34B) (K)
(A) Fe – 2e- = Fe2+ окисление
(К) 2Н+ + 2е- = Н2 восстановление
Суммарно: Fe + 2Н+ = Fe2+ + Н2
В молекулярной форме: Fe + 2НСl = FeCl2 + H2
Коррозия наносит большой экономический ущерб, поэтому защита металлов от коррозии имеет очень важное значение. Методы защиты металлов от коррозии разнообразны:
1)Легирование металлов (введение хрома, никеля, титана, меди и т.д.), вызывающие их пассивность.
2)Механическая защита путем нанесения на металл слоя масла, краски, эмали, лака и т. д. Лаки и краски, растворенные в льняном, при высыхании образуют плотное покрытие. Пленки, полученные при высыхании красок с растворителем, включающим полимеры, имеют большое количество пор, через которые О2, СО2 и влага воздуха проникают к поверхности и разрушают металл.
3)Химическая защита – нанесение химическим путем на поверхность изделия различных пленок (оксидные, фосфатные)
4)электрохимическая защита – покрытие защищаемого металл слоем другого металла. При этом защита осуществляется менее активным металлом (катодное покрытие), а иногда – более активным (анодное покрытие). При нарушении целостности анодного покрытия разрушается покрытие, а металл остается защищенным. При нарушении катодного покрытия разрушается защищаемый металл.
5)Протекторная защита – присоединение протектора (более активного металла, являющегося анодом) к защищаемой металлической конструкции, работающей в воде или почве (изделие становится катодом). В результате протектор разрушается, а защищаемая конструкция предохраняется от коррозии. Этот метод наиболее часто применяется для защиты трубопроводов, подземных кабелей, днищ морского транспорта.
6)При катодной защите внешним током защищаемую деталь присоединяют к катоду внешнего источника постоянного тока, а к аноду – дополнительный электрод или конструкцию из металлического лома. Материал этой дополнительной конструкции при коррозии окисляется, а защищаемая деталь (катод), не корродирует.
7)Применение ингибиторов, т.е. веществ, замедляющих коррозию. Ингибиторами коррозии являются соединения хрома, фосфаты, некоторые органические соединения.
8)Регулирование состава коррозионной среды.
При электрохимической защите металла (железо) наиболее часто используются цинковое анодное покрытие (оцинкованное железо) или оловянное катодное покрытие (луженое железо). При нарушении этих покрытий происходят следующие процессы.
Примеры электрохимической защиты
1.Оцинкованное железо (при нарушении анодного покрытия):
а) Нейтральная среда (влажный воздух):
(А) Zn (E0Zn2+/ Zn = - 0,76B) │H2O, O2 │Fe (E0Fe2+/ Fe = -0.44B) (K)
(A) Zn – 2e- = Zn2+ окисление
(К) 2H2O + O2 + 4е- = 4ОН- восстановление
Суммарно: 2Zn + 2H2O + O2 = 2Zn2+ + 4OH-
В молекулярной форме: 2Zn + 2H2O + O2 = 2Zn(OH)2
б) Кислая среда:
(А) Zn (E0Zn2+/ Zn = - 0,76B) │H2SO4 │Fe (E0Fe2+/ Fe = -0.44B) (K)
(A) Zn – 2e- = Zn2+ окисление
(К) 2Н+ + 2е- = Н2 восстановление
Суммарно: Zn + 2H+ = Zn2+ + H2
В молекулярной форме: Zn + H2SO4 = Zn SO4 + H2
В результате нарушения целостности цинкового покрытия Zn становится анодом, а Fe – катодом. Происходит дальнейшее разрушение цинкового покрытия, а железо не разрушается, на нем происходит выделение водорода или восстановление кислорода.
2.Луженое железо (при нарушении катодного покрытия):
а) Нейтральная среда (влажный воздух):
(А) Fe (E0Fe2+/ Fe = -0.44B) │H2O, O2 │Sn (E0Sn2+/ Sn = - 0,14В) (К)
(A) Fe – 2e- = Fe2+ окисление
(К) 2H2O + O2 + 4е- = 4ОН- восстановление
В молекулярной форме: 2 Fe + 2 H2O + O2 = 2 Fe(ОН)2
б) Кислая среда:
(А) Fe (E0Fe2+/ Fe = -0.44B) │ H2SO4│Sn (E0Sn2+/ Sn = - 0,14В) (К)
(A) Fe – 2e- = Fe2+ окисление
(К) 2Н+ + 2е- = Н2 восстановление
Суммарно: Fe + 2Н+ = Fe2+ + Н2
В молекулярной форме: Fe + 2H2SO4 = FeSO4+ H2
Известно, что потенциалы металлов зависят от состава растворов электролита. Характер защитного покрытия может меняться в зависимости от рН среды. В кислой среде потенциал водорода становится более отрицательным, чем потенциал олова, поэтому его восстановление становится невозможным. В этих условиях олово – анод.
Анод Sn – 2e- = Sn2+ окисление
Катод 2Н+ + 2е- = Н2 восстановление
В «белой жести» - луженом железе, используемом при изготовлении консервных банок, в случае нарушения покрытия анодом становится олово. Растворяясь в кислой среде, олово в виде соли попадает в организм человека с консервированными продуктами. К счастью, неорганические соли олова не отличаются особой токсичностью.
3.Протекторная защита от коррозии
От коррозии широко используют протекторную защиту (например, на нефтяных промыслах, ведущихся в море) используют протекторы, представляющие собой слитки сплава магния и алюминия, т.е. металлов, химически более активных, чем железо. Протекторы навешивают на погруженные в морскую воду части стальных эстакад. В результате возникновения разности потенциалов между электродами: железным (эстакада) и алюминиево-магниевым (протектор) – растворяется, а железный электрод не расходуется, так как на нем концентрируются электроны растворяющегося протектора и за их счет образуется молекулярный водород.
Схематично это выглядит так:
Mg – 2e- = Mg2+ (протектор)
2Н2О + 2е- = Н2 + 2ОН- (эстакада)
Суммарно: Mg + 2Н2О = Mg(ОН)2 + Н2
Образующийся на протекторе гидроксид магния быстро смывается морской водой и не мешает дальнейшему растворению магния (или алюминия). Таким образом, железо не корродирует. Аналогично защищают корпуса кораблей, различные установки, трубопроводы и др.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1502; Нарушение авторских прав?; Мы поможем в написании вашей работы!