
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Самостоятельно рассмотреть экспериментальное обоснование этих положений
|
|
|
|
В МКТ базовым является понятие идеального газа, который отвечает следующим свойствам:
1) 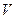 молекул пренебрежимо мал по сравнению с
молекул пренебрежимо мал по сравнению с 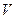 сосуда;
сосуда;
2) между молекулами и атомами газа нет взаимодействия;
3) столкновения между молекулами и атомами газа, а также со стенками сосуда считаются абсолютно упругими.
Реальные газы при небольших давлениях близки к идеальным.
ОСНОВНОЕ УРАВНЕНИЕ МКТ
 Число частиц (молекул, атомов, ионов) в единице объема называется концентрацией.
Число частиц (молекул, атомов, ионов) в единице объема называется концентрацией. 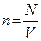
Давление идеального газа на стенку сосуда можно найти так:
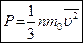 - основное уравнение МКТ,
- основное уравнение МКТ,
где 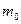 - масса молекулы,
- масса молекулы, 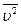 - средняя квадратичная скорость движения молекул газа.
- средняя квадратичная скорость движения молекул газа.
Причем 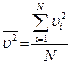 ,
, 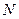 - число молекул газа, квадраты скоростей которых усредняют.
- число молекул газа, квадраты скоростей которых усредняют.
Основное уравнение МКТ можно преобразовать так
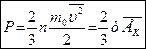 - основное уравнение МКТ,
- основное уравнение МКТ,
где 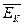 - средняя кинетическая энергия поступательного движения молекул газа.
- средняя кинетическая энергия поступательного движения молекул газа.
ГАЗОВЫЕ ЗАКОНЫ
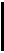 Количеством вещества (
Количеством вещества (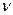 - дана из основных в СИ) называется физическая величина, определяемая числом структурных элементов - молекул, атомов или ионов, из которых состоит вещество. Так как массы отдельных структурных элементов (например, молекул) отличаются друг от друга, то одинаковые количества разных веществ имеют разную массу.
- дана из основных в СИ) называется физическая величина, определяемая числом структурных элементов - молекул, атомов или ионов, из которых состоит вещество. Так как массы отдельных структурных элементов (например, молекул) отличаются друг от друга, то одинаковые количества разных веществ имеют разную массу.
Число атомов (молекул или других структурных единиц), содержащихся в одном моле вещества, называется постоянной Авогадро 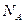 :
: 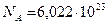 моль-1.
моль-1.
Молярная масса 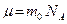 , где
, где 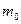 - масса одного структурного элемента (атома, молекулы, иона).
- масса одного структурного элемента (атома, молекулы, иона).
 Количество вещества массой
Количество вещества массой 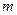 определяется выражением
определяется выражением 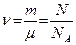 , где
, где 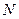 - число структурных элементов (атомов, молекул, ионов).
- число структурных элементов (атомов, молекул, ионов).
Объем одного моля газа равен: (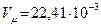 м3/моль) при нормальных условиях, т.е.
м3/моль) при нормальных условиях, т.е.  Па,
Па, 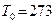 К или
К или 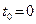 °С.
°С.
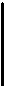 Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений 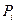 входящих в неё газов
входящих в неё газов
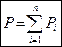 ,
,
где 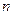 число газов в смеси.
число газов в смеси.
Парциальное давление – это давление газа на те же стенки сосуда, если бы он один находился в нем.
Общее эмпирическое уравнение состояния идеального газа носит название уравнения Клапейрона (фр. физик) и выглядит так
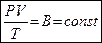 , где
, где 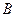 - газовая постоянная, у каждого газа своя.
- газовая постоянная, у каждого газа своя.
При фиксации (постоянстве) одного из термодинамических параметров (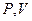 и
и 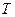 ) из уравнения Клапейрона получаются частные газовые законы, описывающие определенные изопроцессы.
) из уравнения Клапейрона получаются частные газовые законы, описывающие определенные изопроцессы.
 Закон Бойля-Мариотта (англ.- фр.): для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянна.
Закон Бойля-Мариотта (англ.- фр.): для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянна.
при 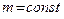 и
и 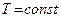
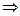
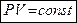 .
.
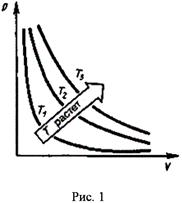
График зависимости между 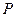 и
и 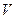 в этом случае называется изотермой (см. рис. 1.), а процесс изотермическим.
в этом случае называется изотермой (см. рис. 1.), а процесс изотермическим.
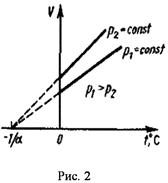
 Закон Гей-Люссака: для данной массы газа при постоянном давлении объем линейно зависит от температуры.
Закон Гей-Люссака: для данной массы газа при постоянном давлении объем линейно зависит от температуры.
 при
при 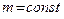 и
и 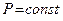 ,
, 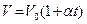 , где
, где  К-1 – коэффициент объемного расширения,
К-1 – коэффициент объемного расширения,  - объем газа при 0 °С.
- объем газа при 0 °С.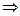
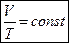 .
.
График зависимости между 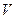 и
и 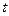 в этом случае называется изобарой (см. рис. 2.), а процесс изобарным.
в этом случае называется изобарой (см. рис. 2.), а процесс изобарным.
 Закон Шарля: для данной массы газа при постоянном объеме давление линейно зависит от температуры.
Закон Шарля: для данной массы газа при постоянном объеме давление линейно зависит от температуры.
 при
при 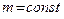 и
и 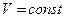 ,
,  , где
, где 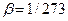 К-1 – коэффициент объемного расширения,
К-1 – коэффициент объемного расширения, 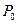 - объем газа при 0°С.
- объем газа при 0°С.
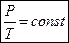 .
.
График зависимости между 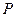 и
и 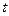 в этом случае называется изобарой (см. рис. 3.), а процесс изобарным.
в этом случае называется изобарой (см. рис. 3.), а процесс изобарным.
Для 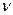 молей газа справедливо уравнение Менделеева-Клапейрона
молей газа справедливо уравнение Менделеева-Клапейрона
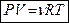 ,
,
где 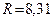 Дж/(моль∙К) – универсальная газовая постоянная. Физ. смысл – это энергия, необходимая для нагревания одно моля газа на 1 К.
Дж/(моль∙К) – универсальная газовая постоянная. Физ. смысл – это энергия, необходимая для нагревания одно моля газа на 1 К.
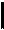 Величина, равная отношению универсальной газовой постоянной к постоянной Авогадро, называется постоянной Больцмана:
Величина, равная отношению универсальной газовой постоянной к постоянной Авогадро, называется постоянной Больцмана:
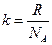 =1,38 Дж/К.
=1,38 Дж/К.
Физ. смысл – это энергия приходящаяся на одну молекулу газа, при его нагревании на 1 К.
Можно записать 3-ию формулу основного уравнения МКТ
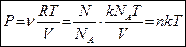 - основное уравнение МКТ.
- основное уравнение МКТ.
ОСНОВЫ ТЕРМОДИНАМИКИ
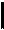 Число независимых движений, которые может совершать точка (система точек) называется числом степеней свободы (i).
Число независимых движений, которые может совершать точка (система точек) называется числом степеней свободы (i).
Так у материальной точки 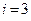 , у двух жестко связанных точек -
, у двух жестко связанных точек - 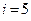 , у трех -
, у трех -  .
.
Число степеней свободы у молекулы в классической теории
i = iпост+iвр+2iколеб .
Так у молекул О2 и N2: i = 3 пост+2вр .
Энергия молекулы газа пропорциональна 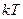 . В случае усреднения обычно пишут
. В случае усреднения обычно пишут
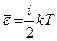 - средняя энергия молекулы.
- средняя энергия молекулы.
При 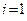
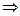
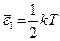 - энергия, приходящаяся на одну степень свободы.
- энергия, приходящаяся на одну степень свободы.
В идеальном газе (где нет взаимодействия) вся внутренняя энергия обеспечивается кинетической формой. Поэтому для 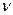 молей газа можно записать
молей газа можно записать
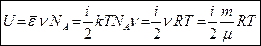 - внутренняя энергия идеального газа.
- внутренняя энергия идеального газа.
ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Если не изменяется механическая энергия системы, но происходит изменение её внутренней энергии, то применим первый закон термодинамики.
Изменение внутренней энергии системы возможно лишь двумя способами: передачей (отбором) теплоты и совершением системой (над системой) некоторой работы.
При этом происходит превращение механической энергии во внутреннюю (тепловую) и наоборот.
I закон Т. – это закон сохранения и превращения энергии, применяемый к термодинамическим процессам.
Пусть  - изменение внутренней энергии системы,
- изменение внутренней энергии системы,
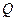 - количество теплоты переданной системе,
- количество теплоты переданной системе,
 - работа системы над внешними силами, тогда:
- работа системы над внешними силами, тогда:
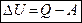 или - I закон Т. в интегральной форме.
или - I закон Т. в интегральной форме.
В дифференциальной форме он выглядит так: 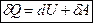 .
.
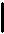 Количество теплоты, переданной системе, идет на изменение её внутренней теплоты и на совершение ей работы.
Количество теплоты, переданной системе, идет на изменение её внутренней теплоты и на совершение ей работы.
Если  , т.е. нет изменения внутренней энергии системы, то
, т.е. нет изменения внутренней энергии системы, то 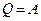 и вся переданная энергия идет на совершение работы, при этом «выигрыша» в работе нет
и вся переданная энергия идет на совершение работы, при этом «выигрыша» в работе нет 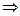 вечный двигатель первого рода – невозможен, поскольку всегда есть силы трения, «ворующие» энергию из системы, и уж тем более такая система не может «приносить» полезную работу.
вечный двигатель первого рода – невозможен, поскольку всегда есть силы трения, «ворующие» энергию из системы, и уж тем более такая система не может «приносить» полезную работу.

 Работой расширения идеального газа называется работа, которую совершает газ против внешнего давления.
Работой расширения идеального газа называется работа, которую совершает газ против внешнего давления.
Элементарная работа 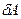 определяется формулой
определяется формулой 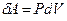 , где
, где 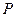 - внешнее давление,
- внешнее давление, 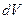 - изменение объема газа. При расширении газа он совершает положительную работу против внешних сил (
- изменение объема газа. При расширении газа он совершает положительную работу против внешних сил (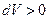 ). При сжатии газа совершается отрицательная работа (
). При сжатии газа совершается отрицательная работа (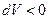 ).
).
Работа расширения при изменении объема газа (или любого тела) от 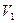 , до
, до 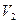 , равна сумме элементарных работ
, равна сумме элементарных работ 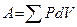 . Например, в случае изобарного процесса при котором
. Например, в случае изобарного процесса при котором 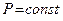 , работа расширения
, работа расширения 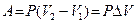 , где
, где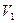 и
и 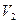 - начальный и конечный объемы тела. При изобарическом процессе работа расширения изображается на диаграмме
- начальный и конечный объемы тела. При изобарическом процессе работа расширения изображается на диаграмме 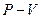 площадью заштрихованного прямоугольника (рис. 4).
площадью заштрихованного прямоугольника (рис. 4).
ТЕПЛОЕМКОСТЬ
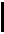 Удельная теплоемкость вещества – величина, равная количеству теплоты
Удельная теплоемкость вещества – величина, равная количеству теплоты 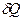 , необходимому для нагревания 1 кг вещества на 1 К:
, необходимому для нагревания 1 кг вещества на 1 К:
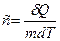 .
.
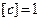 Дж/(кг∙К).
Дж/(кг∙К).
Если взять 1 моль вещества, то получится молярная теплоемкость:
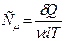 .
.
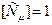 Дж/(моль∙К).
Дж/(моль∙К).
Формула связи 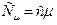 .
.
Различают теплоемкости при постоянном объеме 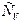 и постоянном давлении
и постоянном давлении 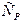 . Причем:
. Причем: 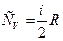 ,
, 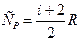 .
.
Формула связи  - уравнение Майера.
- уравнение Майера.
Вводят величину  . Для каждого газа она своя.
. Для каждого газа она своя.
 Процесс, при котором между системой и окружающей средой отсутствует теплообмен (
Процесс, при котором между системой и окружающей средой отсутствует теплообмен (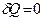 ), называется адиабатным процессом.
), называется адиабатным процессом.
На практике любой быстро протекающий процесс можно считать адиабатным.
Т.к. 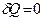
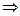
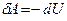 , т.е. газ может совершать работу в этом случае только за счет убыли внутренней энергии.
, т.е. газ может совершать работу в этом случае только за счет убыли внутренней энергии.
Уравнение адиабатного процесса выглядит так: 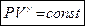 - уравнение адиабаты или уравнение Пуассона, где
- уравнение адиабаты или уравнение Пуассона, где 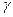 - показатель адиабаты.
- показатель адиабаты.
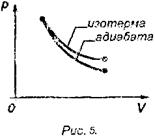
На рисунке 5 показана адиабата в сравнении с изотермой.
ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
На практике, если система, пройдя через ряд состояний, возвращается в исходное, то говорят об круговом процессе (или цикле). Различают прямой (Рис. 6а.) или обратный циклы (Рис. 6б.). К первому относятся тепловые машины (двигатели), ко второму - холодильные установки.
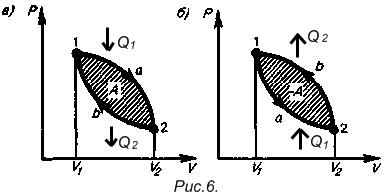
 Поскольку в цикле нет изменения внутренней энергии, т.е.
Поскольку в цикле нет изменения внутренней энергии, т.е. 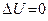 , то
, то 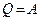 . При этом
. При этом 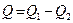 , где
, где 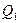 - количество теплоты полученной системой из вне,
- количество теплоты полученной системой из вне, 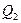 - количество теплоты отданное системой во вне.
- количество теплоты отданное системой во вне.
Для такой установки КПД равен:
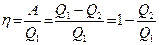 .
.
 Любой термодинамический процесс, способный протекать в прямом и обратном направлении и не вызывающий никаких каких-либо изменений в Т.С. и окружающей среде, называется обратимым.
Любой термодинамический процесс, способный протекать в прямом и обратном направлении и не вызывающий никаких каких-либо изменений в Т.С. и окружающей среде, называется обратимым.
В этом случае не происходит диссипации энергии, т.е. нет никаких потерь. Это идеальный процесс.
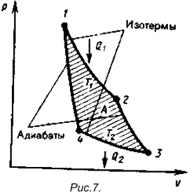
Примером такого процесса может являться идеальный цикл Карно, состоящий из двух изотерм и двух адиабат (см. рис. 7.).
КПД двигателя, работающего по циклу Карно находится так:
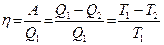 ,
,
где 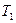 - температура нагревателя,
- температура нагревателя, 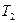 - температура холодильника. Из формулы видно, что КПД такой установки равен 100% лишь при равенстве нулю температуры холодильника, т.е. при абсолютном нуле. Так же видно, что КПД такой машины самый большой для всех идеальных циклов.
- температура холодильника. Из формулы видно, что КПД такой установки равен 100% лишь при равенстве нулю температуры холодильника, т.е. при абсолютном нуле. Так же видно, что КПД такой машины самый большой для всех идеальных циклов.
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- устанавливает направление протекания процессов в Т.С., а также определяет какие из них могут существовать.
Существует несколько формулировок II закона Т.
Закон возрастания энтропии (меры хаоса): в процесса, происходящих в замкнутой Т.С., энтропия 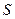 не убывает
не убывает
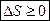 .
.
По Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача тепла от менее нагретого тела к более нагретому.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 246; Нарушение авторских прав?; Мы поможем в написании вашей работы!