
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Очистка газов от диоксида серы
|
|
|
|
Отходящие газы, содержащие оксид серы (IV) характеризуются, как правило, низкой концентрацией SO2, высокими температурами и значительным содержанием пыли.
Для очистки газов от диоксида серы используют, в основном, хемосорбцию. В качестве поглотителей применяют: воду, водные растворы и суспензии щелочных и щелочно-земельных металлов.
Абсорбция водой
Реакция, протекающая при абсорбции водой:
SO2 + H2O ↔ H2SO3 ↔ H+ + HSO3-
Так как диоксид серы плохо растворим в воде, для очистки требуется большой её расход и абсорберы с большими объёмами. Процесс ведут при температуре около 100 0С, следовательно, он сопровождается ещё и высокими энергозатратами.
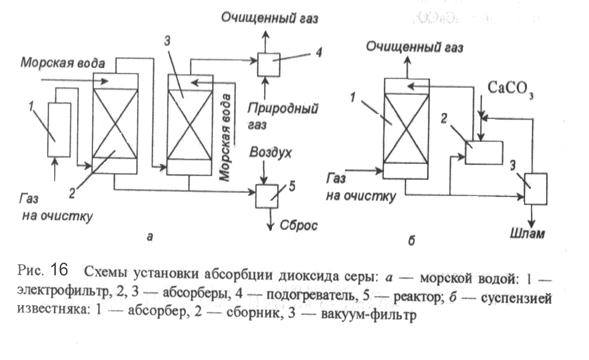
На рисунке 16а показана схема норвежского процесса, в котором в качестве поглотителя SO2 используется морская вода, имеющая слабощелочную реакцию, благодаря чему увеличивается растворимость в ней диоксида серы. В электрофильтре (1) происходит очистка от золы, в полых скрубберах Вентурри (2,3) абсорбция и охлаждение, после подогрева в аппарате (4) очищенные газы выбрасываются а атмосферу. Полученные в абсорберах в результате реакции взаимодействия диоксида серы с солями морской воды сульфитные соединения перед сбросом в море окисляются в реакторе (5) до сульфатов.
Известняковые и известковые методы
Достоинства:
-простая технологическая схема;
- низкие эксплуатационные затраты;
- доступность и дешевизна сорбента;
- возможность очистки без преварительного охлаждения и обеспыливания.
Недостатки:
-зарастание систем охлаждения гипсом;
- коррозия и эррозия оборудования;
- значительный брызгоунос;
- образование осадков.
В качестве реагентов используются:
Известняк, % масс.: SiO2 – 5,19; TiO2 – 0,06; Al2O3 – 0,81; Fe2O3+FeO – 0,54; MnO – 0,05; CaO - 42,61; MgO – 7,9; K2O – 0,33; Na2O – 0,05; H2O - 0,76; CO2 - 41,58; P2O5 – 0,04; S – 0,09; SO3 – 0,05; Cl2 – 0,02
Доломит, % масс.: CaCO3 + MgCO3: CaO – 30,4; MgO – 21,7: CO2 – 47,9
Мергель (осадочная горная порода глинисто-карбонатного состава), % масс.: SiO2 -8,02÷53,32; Al2O3 – 1,52÷9,92; Fe2O3 – 0,44÷3,3; MgO – 0,26÷1,95; CaO – 18,18÷50,44; SO3 – 0,05÷0,75.
Известь – Са(ОН)2, получаемая обжигом карбонатных пород при 1100-1300 0С:
СаСО3→ СаО + СО2
СаО + Н2О → Са(ОН)2
Химические реакции, протекаемые в известняковых и известковых методах:
SO2 + Н2О↔ H2SO3
CO2+ Н2О↔ H2CO3
CaCO3 + H2SO3↔ CaSO3 + H2CO3
CaCO3 + H2CO3↔ Ca(HCO3)2
CaSO3 + H2SO3↔ Ca(HSO3)2
Ca(HSO3)2 + 2 CaCO3↔ Ca(HCO3)2 + 2 CaSO3
Ca(HCO3)2 + 2 H2SO3↔ Ca(HSO3)2 + 2 H2CO3
Ca(HSO3)2 + O2↔ Ca(HSO4)2
2CaSO3 + O2↔2 CaSO4
Сульфит и сульфат кальция гидратируются с образованием соответствующих осадков:
CaSO3+ 0,5Н2О↔ CaSO3∙0,5Н2О
CaSO4+ 2Н2О↔ CaSO4∙2Н2О (гипс)
Наличие примесей усложняет процесс очистки.
Известняковые и известковые методы делятся на нерекуперационные и рекуперационные (позвляют выделять хемосорбент и использовать его в новом цикле очистки).
К нерекуперационным методам относится очистка с использованием СаСО3, схема которой приведена на рисунке 16 б.
В качестве реагента использована суспензия известняка с частицами размером 0,1 мм, соотношением Т:Ж=1:10, рН суспензии 6-6,2; достигаемая степень очистки 85%, коэффициент использования извести около 50 %.
Это один из распространённых методов очистки отходящих газов ТЭС, но главным его недостатком является образование значительных объёмов осадков. Так на ТЭС мощьностью 1000 МВт образуется примерно 780 т шлама в год, содержащего сульфит кальция и до 65% воды. Шлам, как правило, захоранивают после сгущения, но возможна его переработка в материал для дорожного строительства, включающая его предварительное окисление (сульфита в сульфат). Окисление и переработка шлама оправданы экономически.
Также нерекуперационным является способ очистки отходящих газов ТЭС с помощью суспензии летучей золы, являющейся отходом процесса сжигания твердого или жидкого топлива. Схема процесса приведена на рисунке 17 а.
Химический состав золы, % масс.: SiO2 -30÷68; Al2O3 – 10÷40; Fe2O3 – 2÷3; MgO – 0,8÷4,8; CaO – 1,5÷50; SO3 – 0,22÷1,56; TiO2 -0,3÷0,9; Na2O – 0,045÷1,1; К2О – 0,5÷1,3.
Химические реакции процесса:
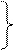 |
СаО + Н2О↔ Са(ОН)2↔ Са2+ + 2ОН- рН>7
MgO+ Н2О↔ Mg(ОН)2↔ Mg2+ + 2ОН-
Остальные оксиды образуют соответствующие гидроксиды
HSO3- + ОН- ↔ SO32- + Н2О
HSO3- + 0,5О2 ↔ НSO4-
Образующиеся в результате осадки, состоящие из отработанной золы и сульфата кальция, могут быть использованы в производстве стройматериалов.
Рекуперационные методы:
- магнезитовый;
-цинковый;
- с использованием хемосорбентов на основе солей натрия;
- двойной щелочной (с использованием солей натрия, калия и аммония);
- аммиачные;
- с использованием расплавов солей (карбонатов щелочных металлов);
- с использованием ароматических аминов.
В магнезитовом методе, схема которого приведена на рисунке 17 б, в качестве хемосорбента применяется оксид-гидроксид магния. В процессе очистки протекают следующие реакции:
MgO+ Н2О↔ Mg(ОН)2
Mg(ОН)2 + HSO3-↔ Mg (HSO3)2 + H2O
Mg(ОН)2 + SO32-↔ Mg SO3 + H2O
Mg SO3+ Н2О+ SO2 = Mg (HSO3)2
Mg (HSO3)2 + Mg(ОН)2= ↓2 Mg SO3 + H2O
2 Mg SO3 + О2 = 2↓ Mg SO4 – нежелательный процесс
Образовавшийся осадок сульфита магния отделяют и подвергают разложению в аппарате (5): Mg SO3 = MgO + SO2↑
Образующийся оксид магния снова используется для приготовления рабочей суспензии (Т:Ж =1:10, рН на входе в абсорбер 6,8-7,5, на выходе 5,5-6), а диоксид серы с концентрацией 7-15 % направляют на переработку в серную кислоту. Абсорбция происходит в скуббере Вентури, орошаемом циркулирующей суспензией.
Достоинства метода:
- возможность очищать горячие газы без предварительного охлаждения;
- получение в качестве продукта серной кислоты;
- доступность и дешевизна хемосорбента;
- высокая эффективность очистки.
Недостатки метода:
- сложность технологической схемы;
- неполное разложение соединений магния при обжиге (Mg SO4);
- значительные потери хемосорбента при регенерации.
Аппаратура (абсорберы)
Используют пустотелые абсорберы с форсунками и скрубберы Вентури (одно и двухступенчатые), также абсорберы с подвижной шаровой насадкой из полиэтилена или резины. На рисунке 18 представлен абсорбер, сочетающий полую секцию с форсунками и секцию с барботажными тарелками.

Требования к аппаратуре:
- высокая эффективность;
- высокая пропускная способность по газу;
- низкое гидравлическое сопротивление (до 3кПа);
- простота конструкции;
- удобство эксплуатации;
- низкая металлоёмкость;
- не должны забиваться осадками.
Лекция 6
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4241; Нарушение авторских прав?; Мы поможем в написании вашей работы!