
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Условия равновесия в гетерогенной системе
|
|
|
|
Возможность T1≠T2 
Направление T1>→T2< 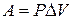
Предел T1=T2 T, P – факторы интенсивности
Для определения возможности, направления и предела протекания процессов в гетерогенных системах можно воспользоваться выражением 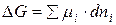 (µi – химический потенциал) – фактор интенсивности фазового перехода.
(µi – химический потенциал) – фактор интенсивности фазового перехода.
На рисунке представим схему перехода некоторого малого количества компонента i из фазы I в фазу II.
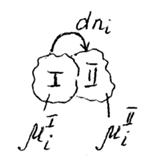
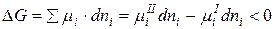
µiI >µiII
Возможность фазового перехода определяется химическим потенциалом.
1) Возможность процесса: µiI ≠ µiII
2) Направление процесса: если µiI >µiII , то I → II
3) Предел процесса: µiI = µiII
Если, например, жидкость находится в равновесии со своим паром, то химический потенциал является одним и тем же для пара и жидкости (µiж = µiп). При повышении температуры химический потенциал компонента в газовой среде снижается и становится ниже его химического потенциала в жидкой среде. Тогда в соответствии с условием µiж > µiп часть жидкости будет самопроизвольно испаряться до тех пор, пока не произойдет выравнивание химических потенциалов сопряженных фаз.
Влияние внешних параметров на фазовое равновесие и фазовые переходы определяется правилом фаз Гиббса.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 242; Нарушение авторских прав?; Мы поможем в написании вашей работы!