
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон Рауля
|
|
|
|
II. Растворы подразделяются также по степени взаимодействия растворителя и растворенного вещества.
I. Растворы классифицируются по агрегатному состоянию растворителя и растворенного вещества.
Растворы могут быть жидкими, твердыми и газовыми.
Растворителем может быть твердое вещество, жидкость и газ.
Практически все газы друг в друге растворяются. В жидкостях растворяются жидкости, газы и твердые вещества. В твердых телах растворяются только твердые тела. В твердых растворах происходит образование гомогенной системы из твердых компонентов.
Газовые растворы – это растворы газов, жидкостей и твердых тел в газах. В пределе при нулевом давлении любой реальный газ представляет систему независимых друг от друга частиц, т.е. обладает признаками идеальной системы. Смесь этих газов, называемая идеальным газом, подчиняется закону Дальтона: 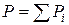 (где Р – общее давление; Рi – парциальное давление i -го компонента). С повышением давления появляется взаимодействие между частицами, тогда смесь реальных газов, паров жидкости и твердых тел рассматривают как газовый раствор.
(где Р – общее давление; Рi – парциальное давление i -го компонента). С повышением давления появляется взаимодействие между частицами, тогда смесь реальных газов, паров жидкости и твердых тел рассматривают как газовый раствор.
Наибольшее распространение получили жидкие, в частности, водные растворы. В случае растворов «жидкость – газ» и «жидкость – твердое тело» растворителем принято считать жидкость. У растворов «жидкость – жидкость» растворителем считают компонент, который находится в избытке по сравнению с другими компонентами, именуемых растворенными веществами.
В зависимости от свойств растворенного вещества различают жидкие растворыне электролитов, электролитов и высокомолекулярных соединений (ВМС). Последние являются предметом рассмотрения в коллоидной химии.
Количество вещества, растворенного в данном объеме растворителя, называется концентрацией.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ:
1)Молярная концентрация М (или молярность) – число молей вещества, растворенного в 1 м3 (или литре) раствора:
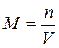
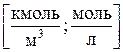
2)Моляльная концентрация т (или моляльность) – число молей растворенного вещества в 1 кг или 1000 г растворителя:
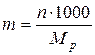
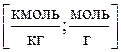
где Mp – масса растворителя.
3)Процентная концентрация ω определяется количеством граммов вещества в 100 г (весовые) или 100 мл (объемные) раствора:
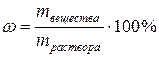 или
или 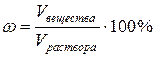
4)Мольная доля N – отношение числа молей ni одного компонента к суммарному числу молей n всех компонентов раствора:
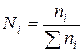
Сумма мольных долей всех компонентов раствора равна единице:
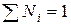
Пример. Проведем расчет М, m и N по известной массовой концентрации серной кислоты ω=98%, плотность раствора равна 1,84 г/л; молярные массы компонентов раствора равны 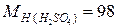 г/моль;
г/моль; 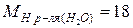 г/моль.
г/моль.
Молярность раствора равна:
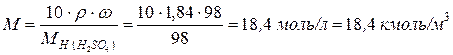
Моляльность раствора составляет:
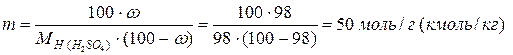
Мольная доля серной кислоты равна:
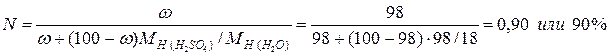
| Растворы | ||
| идеальные | предельно разбавленные | реальные (неидеальные) |
Идеальными растворами называются такие растворы, у которых сила взаимодействия между одноименными и разноименными молекулами одинакова.
А – растворенное вещество, fA-A
В – растворитель, fВ-В
Раствор АВ fA-A= fВ-В= fA-В
В идеальных растворах энергия взаимодействия молекул разных компонентов одна и та же; все молекулы раствора (растворенных веществ и растворителя) обладают одинаковым силовым полем, а объемы молекул всех компонентов равны. В идеальном жидком растворе, в отличие от идеального газа, между молекулами существует взаимодействие. Одинаковая энергия взаимодействия всех молекул в растворе приводит к их равномерному распределению в объеме. Поэтому энтропия смешения компонентов идеального раствора ΔS равна энтропии смешения идеального газа ΔSи.г..
Одинаковый объем всех молекул обуславливает неизменность объема системы при образовании идеального раствора. Тепловой эффект при этом образовании идеального раствора равен нулю. В связи с этим можно дать другое определение идеальных жидких растворов. Идеальными будут такие растворы, образование которых из компонентов, взятых в одинаковом агрегатном состоянии и в любых соотношениях, не сопровождается изменением объема и тепловым эффектом, а изменение энтропии равно изменению энтропии при смешении идеальных газов, т.е.
ΔV=0; ΔH=0; ΔS=ΔSи.г.
Объем и энтальпия идеальных растворов аддитивны и зависят от состава раствора.
Следует иметь в виду, что идеальными могут считаться растворы, когда выполняются все вышеперечисленные условия и, кроме того, должны быть равны парциальные давления компонентов, у них должны быть одинаковая температура и одно и то же агрегатное состояние.
Идеальные растворы потому и называются идеальными, что они не существуют в действительности. Однако имеется значительное число растворов, близких по свойствам к идеальным растворам. К ним относятся разбавленные растворы.
Энергия Гиббса i -го компонента идеального раствора численно равна химическому потенциалу и может быть представлена следующим образом:
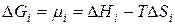
Когда ∆ Hi =0, химический потенциал i -го компонента в идеальном растворе равен:
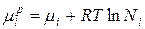 , где
, где
µi, µip – химические потенциалы i -го индивидуального компонента в растворе; Ni –мольная доля i -го компонента.
Продифференцируем данное уравнение и получим:
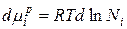
В связи с тем, что 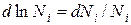 получаем:
получаем:
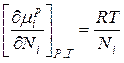
Это уравнение показывает соотношение между химическим потенциалом компонентов идеального раствора и его составом, определяемым мольной долей компонентов раствора.
Рассмотрим предельно разбавленные растворы, которые часто называют просто разбавленными. Предельно разбавленными растворами называются такие растворы, у которых растворитель подчиняется законом идеальных растворов, а растворимое вещество – законам реальных растворов.
Концентрация растворенного вещества в разбавленном растворе бесконечно мала, поэтому взаимодействием между его молекулами можно пренебречь. Тогда предельно разбавленные растворы можно описать закономерностями и уравнениями, которые справедливы для идеальных растворов.
Неидеальными (реальными) растворами называются такие растворы, у которых силы взаимодействия между одноименными и разноименными молекулами различны.
Раствор АВ fA-A ≠ fВ-В ≠ fA-В
Реальные растворы не подчиняются закономерностям идеальных и предельно разбавленных растворов. Однако, введя вспомогательные величины, свойства неидеальных растворов тоже можно выразить через закономерности идеальных растворов.
ДАВЛЕНИЕ НАСЫЩЕННОГО ПАРА НАД РАСТВОРОМ.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 428; Нарушение авторских прав?; Мы поможем в написании вашей работы!