
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамическое обоснование законов Коновалова
|
|
|
|
Для идеальных жидких растворов из двух компонентов (А и В), па которых также можно считать идеальным газом, согласно закону Рауля можно записать
p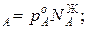 p
p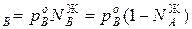
где р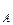 ,р
,р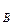 ,р
,р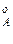 ,р
,р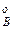 – парциальное давление компонентов А и В раствора и чистых веществ соответственно; N
– парциальное давление компонентов А и В раствора и чистых веществ соответственно; N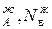 – мольные доли компонентов А и В соответственно в жидком растворе.
– мольные доли компонентов А и В соответственно в жидком растворе.
Поделим эти два уравнения друг на друга и получим:
 (1)
(1)
Из уравнения состояния можно определить мольную долю компонента А в паровой фазе:
рАV=NАпRT
pBV=NBпRT=(1-NAп)RT, т.е.
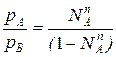 (2)
(2)
где N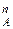 – мольная доля компонента А в паровой фазе.
– мольная доля компонента А в паровой фазе.
Приравнивая уравнения 1 и 2,получим
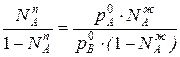
Отношения между мольными долями компонентов в паровой и жидкой фазах можно выразить следующим образом:
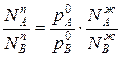 (3)
(3)
Уравнение 3 показывает изменение состава жидкости и пара в соответствии с законами Коновалова. Действительно если рA0> рВ0 (см.диагр.2), то NAп / NВп >N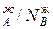 , N
, N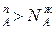 и подтверждается условие N
и подтверждается условие N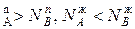 ,характеризующее первый закон Коновалова. Если рA0= рВ0, то правая и левая части уравнения
,характеризующее первый закон Коновалова. Если рA0= рВ0, то правая и левая части уравнения
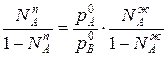
равны и становится справедливым равенство NAп = NAж; NВn= NВж. Условие равенства парциальных давлений компонентов А и В соответствует азеотропной точке О, что фиксируется вторым законом Коновалова.
Анализ уравнения (*).
С ростом концентрации компонента А его парциальное давление, согласно условию р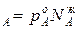 , всегда растет и увеличивается на dp
, всегда растет и увеличивается на dp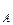 /dN
/dN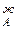 . Одновременно растет общее давление р за счет более летучего компонента А. При dp/dN
. Одновременно растет общее давление р за счет более летучего компонента А. При dp/dN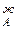 >0 согласно уравнению
>0 согласно уравнению 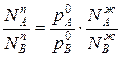 , N
, N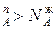 , и подтверждается условие N
, и подтверждается условие N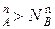 , N
, N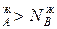 ,а пар обогащается более летучим компонентом, что соответствует первому закону Коновалова.
,а пар обогащается более летучим компонентом, что соответствует первому закону Коновалова.
Для определения экстремума на кривой, описываемой уравнением 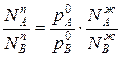 необходимо предположить, что dp
необходимо предположить, что dp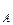 /dN
/dN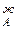 =0. Это означает N
=0. Это означает N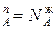 , N
, N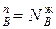 , характерное для азеотропных точек в соответствии со вторым законом Коновалова.
, характерное для азеотропных точек в соответствии со вторым законом Коновалова.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 882; Нарушение авторских прав?; Мы поможем в написании вашей работы!