
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диаграмма состояния неизоморфноплавящихся веществ
|
|
|
|
К типу неизоморфноплавящихся веществ относится система  висмут + кадмий. Они неограниченно растворимы в жидком состоянии, но нерастворимы в твердом состоянии (образуют 2 фазы). Это выражается в том, что при затвердевании расплава кристаллизуется один компонент, в то время как другой остается в расплаве. Поэтому неизоморфные смеси в твердом состоянии неоднородны и состоят из двух твердых фаз: кристаллов компонента А и кристаллов компонента В.
висмут + кадмий. Они неограниченно растворимы в жидком состоянии, но нерастворимы в твердом состоянии (образуют 2 фазы). Это выражается в том, что при затвердевании расплава кристаллизуется один компонент, в то время как другой остается в расплаве. Поэтому неизоморфные смеси в твердом состоянии неоднородны и состоят из двух твердых фаз: кристаллов компонента А и кристаллов компонента В.
Диаграммы таких веществ имеют следующий вид:
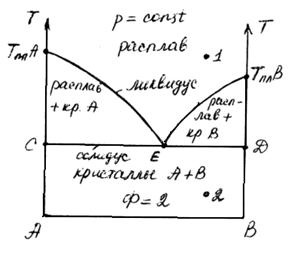
Обычно диаграммы конденсированных систем строят в координатах «состав – температура». Их также называют диаграммами плавности. На осях ординат откладывают температуры плавления чистых веществ А и В (tплA и tплB).
Линия АЕВ – это линия начала кристаллизации, которая называется линией ликвидуса. Все фигуративные точки, лежащие выше линии ликвидуса, характеризуют состав гомогенной части расплава при различных температурах.
По правилу фаз Гиббса:
точка 1 С = К-Ф+n = 2-1+1 = 2 (можно менять состав и температуру)
n=1 при Р=const (изменяется только Т)
Линия СД характеризует конец кристаллизации расплава и называется линией солидуса. Ниже линии солидуса вещества А и В образуют две фазы в твердом состоянии – кристаллы А и кристаллы В. Все фигуративные точки, лежащие ниже линии солидуса, характеризуют состав твердой смеси.
По правилу фаз Гиббса:
точка 2 С=К-Ф+1=2-2+1=1, т.е. при сохранении постоянства состава равновесных твердых фаз произвольно можно изменять только температуру.
Точка Е называется точкой эвтектики. Это точка соответствует равновесию между жидким раствором (расплавом) и двумя кристаллическими фазами. Такое равновесие называется эвтектическим равновесием. Соответствующий жидкий раствор, равновесный этим двум фазам, называется эвтектикой. Этим же термином обозначается и твердый продукт (сплав), образующийся при кристаллизации этого раствора и, следовательно, обладающий эвтектическим составом. Жидкий раствор называют жидкой эвтектикой, а твердый сплав – твердой эвтектикой. Эвтектические сплавы характеризуются малыми размерами и однородностью кристаллов и имеют высокие твердость и механическую прочность.
|
|
|
По правилу фаз Гиббса:
точка Е С=К-Ф+1=2-3+1-0, т.е. расплав эвтектического состава кристаллизуется как чистое вещество при постоянной температуре.
точка А – точка кристаллизации вещества А: С=К-Ф+n=1-2+1-0
Однако, различие между чистым веществом и эвтектикой состоит в том, что при кристаллизации чистого вещества из его расплава состав твердой фазы одинаков с составом жидкого расплава. При кристаллизации эвтектики состав жидкого расплава отличается от состава каждой из равновесных с ним твердых фаз.
Диаграммы плавности с простой эвтектикой, состоящей из чистых компонентов, встречаются довольно часто среди металлических, солевых, органических систем, например, системы Ag-Pb, Zn-Sn, Bi-Cd, KCl-LiCl, AgBr-KBr, хлорид бензоила – дифенил. Диаграммы состояния аналогичного вида характерны и для многих водных солевых систем (диаграммы растворимости), при охлаждении которых кристаллизуются эвтектические смеси, состоящие из воды и солей, называемые криогидратами. Например, системы NH4Cl-H2O, NaNO3-H2O. Явления, связанные с образованием и свойствами эвтектик, известны очень давно. Эвтектики применяются для практических целей. Так, для пайки свинцовых водопроводных труб издавна применяется легкоплавкий припой – третник, состоящий из двух частей олова и одной части свинца, (2 масс. ч. Sn + 1 масс. ч. Pb), очень близкий по составу к эвтектическому сплаву этих металлов.
|
|
|
Эвтектические смеси применяются и для получения искусственного холода, действие которых основано на поглощении теплоты при образовании жидких эвтектик из некоторых солей и снега. Например, смесь шестиводного хлорида кальция со снегом дает понижение температуры до – 50 0С (CaCl2∙6H2O+снег; t3= –50 0С).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 241; Нарушение авторских прав?; Мы поможем в написании вашей работы!