
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Изохорный процесс
|
|
|
|
1. Этот термодинамический процесс имеет место в тех случаях, когда объем газа во время всего процесса остается неизменным;
2. V = const - уравнение процесса.
|






 - семейство изохор.
- семейство изохор.


|
 Семейство изохор - семейство параллельных линий.
Семейство изохор - семейство параллельных линий.
Чем ближе к оси ОР, тем меньше удельный объем V (м3/кг).
3. Уравнение состояния в крайних' точках любого изохорного процесса 1-2 будут выглядеть так:
В т. 1 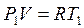 ;
;
В т. 2 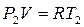 ;
;
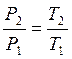 ;
;
В изохорном процессе давление газа пропорционально абсолютной температуре.
Процесс 1-2 - идет с увеличением температуры, а 2-1 - с уменьшением.
4. Изменение внутренней энергии 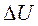 :
:
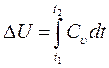
Для идеального газа Cv – const
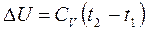
5.Работа в изохорном процессе равна О:
6. Согласно первому закону термодинамики, теплота, подводимая в изохорном процессе, будет идти полностью на увеличение внутренней энергии:

Изобарный процесс
1. Термодинамический процесс, протекающий при постоянном давлении Р = const - называется изобарным.

2. В координатах PV-линии II оси абсцисс:
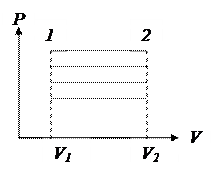 |
3. Для изобарного процесса уравнение состояния идеального газа
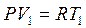
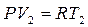
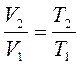
Объемы газов пропорциональны абсолютным температурам.
4. Изменение внутренней энергии 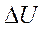 :
:
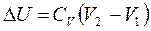 ;
;
5. Работа в изобарном процессе:
 или
или 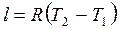
Из последнего выражения для работы легко установить физический смысл газовой постоянной R, если изменение температуры в изобарном процессе будет равно 1 градусу, то R = 1.
Газовая постоянная есть работа, производимая в изобарном процессе 1 кг газа (или 1 кг газа) при изменении его температуры на 1 градус.
6. Теплота, сообщаемая газу в изобарном процессе, будет складываться согласно первому началу термодинамики из изменения внутренней энергии и работы:
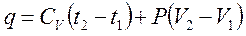
или 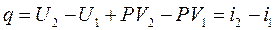
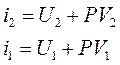
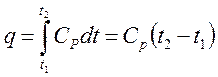
Изотермический процесс
1. Изотермическим называется процесс, осуществляемый при постоянной температуре. Согласно уравнению состояния идеального газа PV = RT, уравнение изотермического процесса выразится постоянством выражения. PV = const -уравнение состояния.
2. В координатах PV изотерма - равнобокая гипербола, т.к. в изотермическом процессе давление обратно-пропорционально объему:







 1-2 изотермическое расширение;
1-2 изотермическое расширение;


 2-1 изотермическое сжатие;
2-1 изотермическое сжатие;
 |
3. Связь между параметрами Т = const:
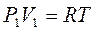 ;
;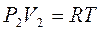
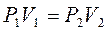
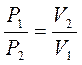 ;
;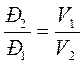
4. Внутренняя энергия остаётся неизменной, поскольку dТ=0;
5. Работа в изотермическом процессе:
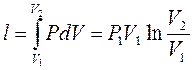 ;
;
т.к. давление в любой точке: 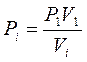
или 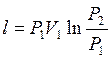 , или
, или 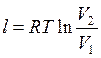 , или
, или 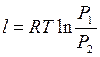 ;
;
6. Поскольку изменений внутренней энергии в изотермическом процессе не происходит, то согласно первому закону термодинамики подведенная теплота будет эквивалентна работе расширения газа q = 1 (процесс 1-2 см. рис.). При сжатии газа от него должна отводиться теплота.
Адиабатный процесс
1. Термодинамический процесс, который совершается рабочим телом без теплообмена с окружающей средой, называется адиабатным. Этот термодинамический процесс объединяет все газовые процессы, которые производятся без отвода и подвода теплоты, т.е. dq = 0. Уравнение адиабатного процесса можно получить, исходя из первого начала термодинамики, из которого при dq = 0 следует, что:
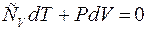
подставляем в данное уравнение выражение dT через Р и V:
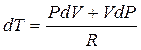

Формула Майера:
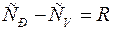
С учётом формулы Майера и элементарных преобразований:
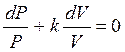
где  - показатель адиабаты после интегрирования уравнения.
- показатель адиабаты после интегрирования уравнения.
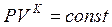
Это уравнение еще называется уравнением Пуассона или адиабатой Пуассона.
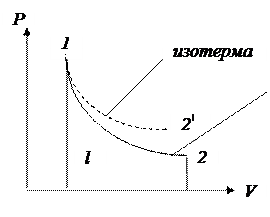
2. Графически адиабатный процесс изображается в виде несимметричной гиперболы в координатах Р – V:
 | |||
 | |||
Адиабата круче изотермы, т.к 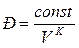 , где К > 1.
, где К > 1.
3. Связь между основными параметрами:
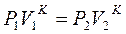
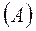
т.к.  и
и 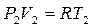
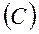
то 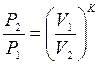
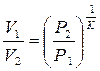 ;
;
или 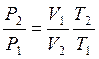 , приравнивая правые части получим:
, приравнивая правые части получим:
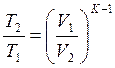 по давлению
по давлению 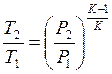
4. Изменение внутренней энергии:
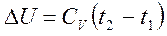
5. Если Р1 и V1 заданные начальные параметры адиабатного процесса, то давление Р в любой точке процесса будет связано с текущим объемом V следующей зависимостью:
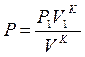
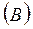
Работа газа в адиабатном процессе будет, с учетом равенства А и В:
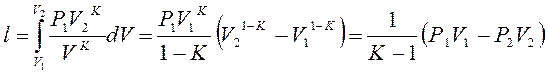
С учётом (С): 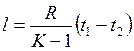
6. Теплота в адиабатном процессе не подводится и не отводится, согласно определению процесса dq = 0, но это не значит, что q = const, поскольку q - функция процесса. Запись dq = 0 надо понимать так: в адиабатном процессе не происходит теплообмена с окружающей средой.
При адиабатном расширении, в соответствии с первым законом термодинамики, работа расширения будет производиться за счет уменьшения внутренней энергии газа, т.е. 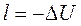 , а при адиабатном сжатии газа производимая над газом работа будет эквивалента увеличению его внутренней энергии, т.е.
, а при адиабатном сжатии газа производимая над газом работа будет эквивалента увеличению его внутренней энергии, т.е. 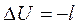 .
.
Политропный процесс
В рассмотренных выше процессах один из параметров состояния сохранялся неизменным и эти процессы часто встречаются (например...).
Общим случаем термодинамического процесса является процесс со всевозможным изменением всех характеристик рабочего тела, такой процесс называется политропным (poly - много; tropos - поворот).
1. Уравнение политропного процесса получим исходя из первого начала термодинамики:
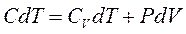 ;
;
dq = CdT - элементарное количество теплоты, подводимого (отводимого) в любом процессе.
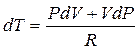 с учётом формулы Майера для R.
с учётом формулы Майера для R.
 - проведя преобразования:
- проведя преобразования:
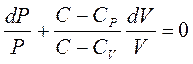 , где
, где 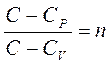 ;
;
При постоянном значении истинной теплоемкости С величина n будет также постоянной.
Т.к. любой термодинамический процесс характеризуется вполне определенным постоянным значением теплоемкости С, то при интегрировании уравнения величину n - можно считать постоянной, что даст нам выражение:
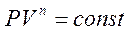 ;
;
Единственным ограничением политропного процесса является постоянство теплоемкости в этом процессе.
Т.к. С в газовых процессах меняется от 0 до 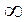 , то и n изменяется от 0 до
, то и n изменяется от 0 до 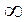 .
.
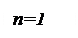




 Все выше рассмотренные процессы являются частным случаем политропного процесса, если n = 0, то Р = const, если n=1, то Т=const, если n=k, то dq=0, если n=
Все выше рассмотренные процессы являются частным случаем политропного процесса, если n = 0, то Р = const, если n=1, то Т=const, если n=k, то dq=0, если n= , то V=const
, то V=const
 3. В системе Р - V координат:
3. В системе Р - V координат:
 а). 1 > n > 0 - изобара – изотерма;
а). 1 > n > 0 - изобара – изотерма;

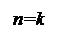
 б). k > n >1 - изотерма – адиабата;
б). k > n >1 - изотерма – адиабата;
 в).
в).  > n > k - адиабата – изохора;
> n > k - адиабата – изохора;
Политропы, идущие вправо от т. А - соответствуют случаю расширения газа, а влево от точки А - соответствуют случаю сжатия газа.
Показатель n может указывать на процесс энергопревращений:
Так  при n=1, Т=const.
при n=1, Т=const.
В политропах, лежащих над изотермой внутренняя энергия увеличивается, т.е. 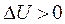 ;
;
В политропах под изотермой внутренняя энергия уменьшается, т.е. 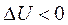 ;
;
В политропах над адиабатой теплота подводится dq>0, под адиабатой соответственно отводится.
В процессах (1>n>0) подводимая теплота идет на увеличение внутренней энергии и на совершение работы расширения.
В случае сжатия - идет уменьшение внутренней энергии и отвод теплоты.
В процессах (k>n>l) - расширение газа за счет подводимой теплоты (dq>0) и уменьшения внутренней энергии 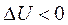 ;
;
Сжатие газа сопровождается увеличением внутренней энергии 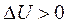 и отводом теплоты (dq<0).
и отводом теплоты (dq<0).
В процессах 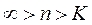 - расширение газа и отвод теплоты будут происходить за счет уменьшения внутренней энергии газа (
- расширение газа и отвод теплоты будут происходить за счет уменьшения внутренней энергии газа (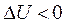 ), а сжатие газа и подвод теплоты сопровождаются увеличением внутренней энергии.
), а сжатие газа и подвод теплоты сопровождаются увеличением внутренней энергии.
Качественные особенности таких энергопревращений подтверждаются зависимостью теплоемкости С от величины n:
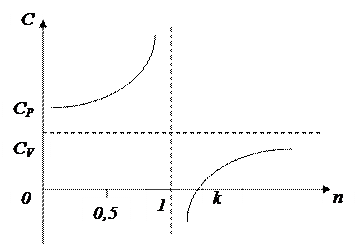 |
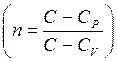
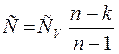
1. При n=0, теплоемкость соответствует изобарному процессу С = Ср;
1>n>0: С>0, dq>0, U>0;
2. При n=1 С стремится к бесконечности;
3. При k>n>l С - имеет отрицательные значения;
4. При n=k C=0
5. При 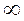 >n>k C>0
>n>k C>0
6. При n=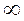 C=CV
C=CV
Определим n:
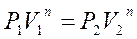

Значения Р и V в уравнение могут вводиться как координаты точек (1) и (2) без учета их масштаба (т.е. величины соответствующих отрезков).
3. Определение связи между основными параметрами состояния производится следующим образом:

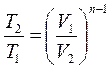
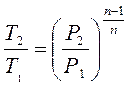
4. Изменение внутренней энергии:
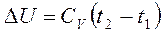
5. Формулы для вычисления работы будут аналогичны формулам адиабатного процесса, только вместо К будет n:
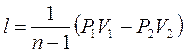

6. Тепловая энергия в политропном процессе вычисляется по зависимости:
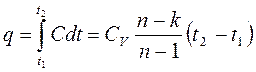
Политропным называется процесс, в котором превращение энергии осуществляется по определенному закону, т.е. процесс, в котором 1/q или 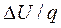 имеют вполне определенные числовые значения.
имеют вполне определенные числовые значения.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1968; Нарушение авторских прав?; Мы поможем в написании вашей работы!