
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальна характеристика методу
|
|
|
|
План
1. Загальна характеристика методу
2. Робочі розчини методу
3. Індикатор йодометрії
4. Приготування та встановлення нормальності робочих розчинів йодометрії
5. Приклади практичного застосування йодометрії
- а) визначення міді
- б) визначення арсену;
- в) визначення органічних пероксидів.
Методи, які базуються на виділенні або поглинанні йоду, називаються йодометрією і займають особливе місце серед інших методів редоксометрії. Ці особливості зумовлені, по-перше, невисоким окислювальним потенціалом йода при переході його в йодид (Е0 = +0,53В), по-друге, хорошою оборотністю цієї реакції, по-третє, слабкою залежністю від рН розчину і присутності комлексоутворювачів. Ці обставини дозволяють вибирати умови реакції, які найбільш придатні для конкретної аналізуємої речовини.
Для усіх йодометричних визначень характерна одна окисно-відновна рівновага:

Значення окисного потенціалу цієї системи займає проміжне становище між такими для типових сильних відновників і сильних окисників, що створює можливість визначення як перших, так а других (див. таблицю редокспотенціалів).
Сильні відновники (SnCl2, Na3SO3 та інші) визначають прямим титруванням робочим розчином йоду (подібно перманганатометрії, дихроматометрії тощо). Для титрування більш слабких відновників необхідно попередньо понизити потенціал відновних систем за допомогою комплексоутворювачів (наприклад пірофосфату або тартрату).
Добре розроблені йодометричні методи визначення вільних металів у порошкоподібному стані, при цьому застосовують зворотнє титрування.
В останньому методі, як і при визначенні окисників, застосовують другий робочий розчин йодометрії, а саме тіосульфат натрію. До розчину окисника додають спочатку надлишок йодиду калію, при цьому виділяється еквівалентна кількість йоду, який відтиттровують тіосульфатом натрію. Цим методом витіснення або заміщення користуються як для визнічення сильних окисників (галогени, їх кисневі сполуки, тривалентне залізо, двохвалентну мідь, п’ятивалентний ванадій), так і для встановлення нормальності KMnO4, K2Cr2O7, KВrO3 та робочих розчинів інших методів редоксометрії
Отже, йодометрія дозволяє використовувати усі три відомі прийоми титрування.
Йодометрія дає унікальну можливість в одному зразку визначити вміст одного і того ж елементу у різних ступенях окиснення, наприклад, аналізувати сполуки п’яти- і трьох- валентного миш’яку. В першому випадку користуються методом витіснення в сильнокислому середовищі, в другій пробі визначають As (III) прямим титруванням йодом.
Йодометрія знаходить застосування і при аналізі паливно-мастильних матеріалів, наприклад, для визначення органічних пероксидів.
Деякою перепоною для широкого впровадження йодометрії при масових аналізах є досить висока вартість йоду та йодиду калію.
2. Робочі розчини йодометрії
Отже, головними робочими розчинами йодометрії є розчини йоду і тіосульфату натрію
Йод, як, відомо, погано розчиняється у воді, тому він застосовується у вигляді розчину в йодиді калію, при цьому утворюється добрерозчинний полійодид:
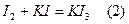
Титрування йодом,в залежності від відновника, можно вести як в кислому, так і в нейтральному або слабколужному середовищі. Не можна титрувати йодом лише в сильнолужному середовищі, тому що при рН>9 помітним стає перебіг реакції:

NaIO ж не дає забарвлення з крохмалем
При визначені окисників їх обробляють йодидом калію;йод, що виділився, титрують тіосульфатом. При цьому відбувається реакція з виділенням тетратіонату:

Важливою перевагою тіосульфату натрію перед іншими відновниками є те, що, як і для йоду, його редокспотенціал не залежить від рН розчину. Саме тому обидва основні розчини йодометрії на відміну від більшості розчинів інших методів можуть застосовуватись в широкому діапазоні рН (аж до 9)
Позитивною рисою тіосульфату є те, що його розчин лише дуже повільно окиснюється киснем повітря.
До недоліків тіосульфату натрію слід внести:
-розклад під дією кислот, як сильних:

так і слабких, таких як вугільна:
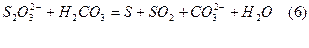 ,
,
що вимагає користуватись для приготування розчинів водою, вільною від СО2 і їх зберігати
-утворення тіобактерій;
-Na2S2O3 дією сильних окисників може окиснюватись не тільки доNa2S2O6, але й до солей інших політіонових кислот, наприклад,
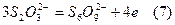
І тільки “м’який” окисник йод стехіометрично переводить тіосульфат у тетратіонат.
В якості допоміжного розчину (не точної концентрації) в йодометрії застосовується розчин йодиду калію. Необхідно користуватись сухими препаратами КІ, або свіжеприготовленими його розчинами. Це пов’язано зі схильністю КІ поглинати кисень повітря з утворенням КІО або КІО3

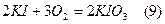
3. Індикатор йодометрії
Основним індикатром йодометрії є крохмаль, який погано розчиняється у воді і тому застосовується у вигляді колоїдного розчину. Останній одержують при нагріванні зависі крохмалю у воді до кипіння.
Чутливість крохмалю до йоду значно підвищується в присутності КІ. Інтенсивно синє забарвлення розчину зобов’язане утворенню т.з. сполук включення декстринів з полійодид-іонами І-3 (крохмаль-(С6Н10О5)n, декстрини-(С6Н10О5)m,n>>m).
Особливістю крохмалю є те, що він може частково відновлювати деякі окисники. Тому при титруванні крохмаль вносять не зразу, а тільки в кінці титрування, коли інтенсивність забарвлення йодом розчину понижується до солом’яно-жовтого кольору. Зрозуміло, що при титруванні відновників робочим розчином йоду, крохмаль додають зразу перед початком титрування.
Крім крохмалю, іноді застосовують інші індикатори, наприклад, екстрагенти-хлороформ (важчий за воду) або бензол (легший за воду). При наявності йоду органічний шар забарвлений у фіалковий колір, у його відсутності він безбарвний. При титруванні необхідне інтенсивне перемішування, щоб між водою і неводними фазами постійно існувала рівновага.
4. Приготування та встановлення нормальності робочих розчинів йодометрії
Робочий розчин йоду взаємодіє з відновниками згідно рівнянню 1. Отже, еквівалентна маса йоду дорівнює молярній масі атомів йоду, тобто 126,91 г/моль.
Реакції йоду з різноманітними відновниками мають високу чутливість; тому часто застосовують 0,05 або 0,02н розчини.
При приготуванні робочих розчинів йоду по наважці слід зважати на його погану розчинність у воді і леткість. Тому спочатку зважують у бюксі розчин КІ (як мінімум, трьохкратна кількість до розрахованої кількості І2), зважують на часовому склі і швидко переносять його в бюкс, і визначають масу І2 за різницею.
Для приготування робочого розчину тіосульфату натрію Na2S2O3·5H2O треба зважати на рівняння реакції (4). При цьому треба брати до уваги наступні фактори. Суха сіль при зберіганні поступово втрачає частину кристалізаційної води, а свіжеприготовлені розчини повільно понижають свій титр внаслідок процесів, описаних у розділі 2 (реакції 5-7). Тому звичайно готують 0,05н розчин Na2S2O3, витримують його декілька днів, а потім визначають нормальність за дихроматом калію, як це буде пояснено далі.
Для попередження подальшого розкладу тіосульфату розчин зберігають у посуді із хлоркальцієвою трубкою, заповненою натронним вапном.
Шкідлива дія СО2 повітря значно знижується, якщо до розчину додати невелику кількість соди:
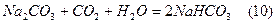
Робочий титрований розчин Na2S2O3 зберігають у темній склянці для захисту від світла і прямих сонячниєх променів,що уповільнює процеси розкладу тіосульфату.
Встановлення нормальності розчину Na2S2O3 базується на реакціях:
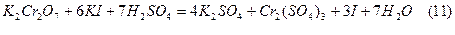
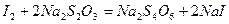
З цих спряжених реакцій видно, що кількість Na2S2O3 еквівалентна кількості взятого K2Cr2O7. Дихромат кілію відповідає усім вимогам для стандартних речовин, тому точну його концентрацію готують по наважці. Еквівалентна маса дихромату складає: 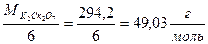
Як правило, для реакції беруть 3-4 краплі надлишок КІ, 15-20 мл розведеної (1:5) сірчаної кислоти на 50-100 мл загального об’єму розчину. Зазвичай використовують 0,05н розчини дихромату і тіосульфату. Титрування проводять до переходу темно-синього кольору в світло-зелений, що зумовлюється присутністю в розчині іонів Сr3+.
Методика встановлення нормальності Na2S2O3 наведена у лабораторному практикумі.
Встановлення нормальності йоду проводять по робочому розчину Na2S2O3, титрування відбувається за рівнянням (4). Подробиці також наведені у методичних вказівках.
5. Приклади практичного застосування йодометрії
а) Йодометричний метод визначення міді є одним з найбільш точних і в цьому відношенні поступається тільки електрохімічним методам.
Принцип методу полягає в проведенні, як це буває завжди при йодометричному визначенні окисників, двох спряжених реакцій:
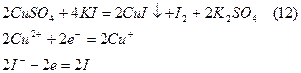
і вже відомої нам реакції:
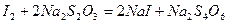
Нормальний потенціал системи Cu2+/Cu+ складає Е0=0,16В, в той час як Е0 системи І2/2І-,згадаємо, дорівнює 0,53В. Тому рівновага системи (12) повинна бути зміщена вправо. Це пояснюється тим, що утворюється малорозчинний осад йодиду міді (І).
Титрування тіосульфатом проводять спочатку до солом’яно-жовтого кольору розчину, потім додають крохмаль і дотитровують до пісочного (пісочно-білого) кольору. Еквівалентна маса міді дорівнює атомній. Деталі проведення аналізу описані в методичних вказівках.
б) Принцип йодометричного визначення арсенітів, що є прикладом визначення відновників, полягає у титруванні їх розчинів вільним йодом в нейтральному середовищі:
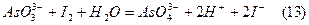
Для нейтралізації кислоти додають гідрокарбонат натрію:
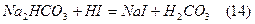
В результаті утворюєть буферна суміш NaHCO3-H2CO3, що зумовлює реакцію середовища в межах 6-7.
в) Йодометрія з успіхом застосовується також для визначення як неорганічних (реакція 15), так і органічних(реакція 16) пероксидів:
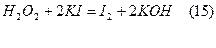

Йод, що виділився, відтитровується, як звичайно, тіосульфатом.
Пероксиди накопичуються у результаті радикально-ланцюгового окиснення речовин органічної природи, як проміжні продукти цих процесів. Отже, їх вміст є мірою ступеня окисненості таких речовин як жири, масла, нафтопродукти тощо. Так, перекисне число, визначене йодометрично, характеризує якість харчових жирів.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3085; Нарушение авторских прав?; Мы поможем в написании вашей работы!