
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Будова, класифікація та властивості білків
|
|
|
|
План
1. Будова, ізомерія та номенклатура амінокислот.
2. Методи добування.
3. Фізичні та хімічні властивості.
4. Будова, класифікація та властивості білків.
5. Синтетичні гомологи білків.
1. Будова. Ізомерія. Номенклатура.
Амінокислотами називають органічні сполуки, молекули яких одночасно містять карбоксильну і амінну групи. В молекулах цих речовин можуть знаходитися одна, дві або більше карбоксильних груп і одна, дві або більше аміногруп. У зв'язку з цим амінокислоти класифікують за кількістю карбоксильних груп (монокарбонові, дикарбонові) і за кількістю аміногруп (моно-, аміно-, діаміно-). Залежно від будови вуглецевого ланцюга амінокислоти поділяють на ациклічні і циклічні, а залежно від взаємного розміщення амінної і карбоксильної груп розрізняють α-, β-, γ-, δ-амінокислоти.
Амінокислоти, як і інші класи органічних речовин, утворюють гомологічний ряд, який можна записати, виходячи з гомологічного ряду карбонових кислот.
Амінокислоти часто називають за назвою відповідної карбонової кислоти, до якої додають слово аміно. Положення аміногрупи відносно карбоксильної позначають грецькими буквами α, β, j (наприклад, α-, β- і γ-аміномасляна кислота). За систематичною номенклатурою назву амінокислоти утворюють з назви відповідного вуглеводню, до якої додають префікс аміно- закінчення – ова і слово кислота. Місцеположення аміногрупи позначають цифрою. Нумерацію вуглецевого ланцюга починають з атома вуглецю карбоксильної групи.
Для назви амінокислот широко використовуються тривіальні назви. Найпростішими амінокислотами є гліцин та аланін.
Амінокислоти досить поширені в природі. Так, α-амінокислоти є складовими частинами білків, беруть участь у найважливіших біологічних процесах і тому відіграють важливу роль у процесах життєдіяльності організмів. У наш час з гідролізатів білків виділено понад 20 α-амінокислот. Для α-амінокислот, виділених з білків, у практику ввійшли їх історичні назви.
Амінокислотам, як і іншим органічним сполукам, властива ізомерія, яка для цих речовин може бути пов'язана з різним положенням аміногрупи відносно карбоксильної (наприклад, α-, β- і γ-аміномасляні кислоти), а також з розгалуженням вуглецевого ланцюга молекули амінокислоти. Таким ізомером α, β і γ-аміномасляних кислот є 2-аміно-2-метилпропанова кислота:
CH3
 |
H3C-C-COOH
 |
NH2
Амінокислоти, молекули яких містять асиметричні вуглецеві атоми, виявляють оптичну активність і існують у вигляді дзеркальних ізомерів, наприклад α-амінопропіонова кислота:
 COOH CООH
COOH CООH
 |
H-C*- NH2 H2N-C*-H
 |  |
CH3 СH3
Д(-)-Аланін L(+)-Аланін
Оптична ізомерія аланіну подібна ізомерії молочної кислоти. Д-аланін повертає площину поляризації світла вліво (-), L(+)-аланін – вправо.
Більшість з амінокислот містять в собі, крім карбоксильних і аміногруп, інші угрупування: гідроксильні, сірковмісні, радикали ароматичних та гетероциклічних сполук.
Всі амінокислоти природних білків є α-амінокислотами і мають асиметричні атоми вуглецю (крім гліцину). Всі α-амінокислоти білків являються L-ізомерами.
CH2-COOH
 |
NH2
гліцин
амінооцтова кислота
CH3-CH-COOH
 |
NH2
аланін, α-амінопропіонова кислота
CH3-CH-CH-COOH
 | |||
 | |||
CH3 NH2
валін
α-аміноізовалеріанова кислота
CH3-CH-CH2-CH-COOH
 | |||
 | |||
CH3 NH2
лейцин
α-аміноізокапронова кислота
CH3-CH2-CH-CH-COOH
 | |||
 | |||
CH3 NH2
ізолейцин, β-метил-α-аміновалеріанова кислота
CH3-CH-CH-COOH
 | |||
 | |||
OH NH2
треонін, β-окси-α-аміномасляна кислота
CH2-CH2-CH-COOH
 | |||
 | |||
SCH3 NH2
метіонін, γ-метилтіо-α-аміномасляна кислота
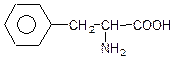
фенілаланін,
β-феніл-α-амінопропіонова кислота
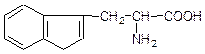
триптофан
β (3-індоліл)-α-амінопропіонова кислота
H2C-CH-COOH
 | |||
 | |||
OH NH2
серин
COOH-CH2-CH-COOH
 |
NH2
аспарагінова кислота
COOH-(CH2)2-CH-COOH
 |
NH2
глютамінова кислота
H2N-(CH2)4-CH-COOH
 |
NH2
лізин
H2N-(CH2)3-CH-COOH
 |
NH2
орнітин
2. Методи добування. α-Амінокислоти L-ряду поширені в природі. Вони є складовими частинами білків. Амінокислоти D-ряду добувають шляхом синтезу. Із синтетичних методів добування амінокислот найважливіші такі:
1) Мікробіологічний синтез відбувається у клітинах мікроорганізмів або поза ними під впливом ферментів, які виділяють мікроорганізми. В наш час навчилися так спрямовувати життєдіяльність деяких мікроорганізмів, що вони не нагромаджують білок, а синтезують певну амінокислоту. Отже, з нехарчової сировини за допомогою мікроорганізмів добувають у промислових масштабах лізин, глютамінову кислоту та деякі інші амінокислоти.
2) Гідроліз білків. Природним джерелом добування амінокислот є білкові речовини. Під час їх гідролізу утворюється суміш амінокислот, з якої відповідними методами виділяють окремі амінокислоти. Білки – це високомолекулярні речовини, макромолекули яких складаються із залишків α-амінокислот, сполучених між собою амідними (пептидними) зв'язками

 -NH-C-
-NH-C-
O
У загальному вигляді частину молекули білка можна схематично зобразити так:
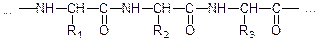
де R1, R2, R3 можуть бути H, CH3, CH2-SH та інші групи атомів.
У процесі гідролізу білків амідний зв'язок розривається і при цьому утворюються відповідні амінокислоти:
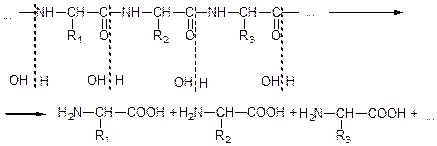
Гідролізом білків добувають цистеїн. лейцин, ізолейцин.
3) Дія аміаку на солі α-галогенкарбонових кислот:
H2NH+Cl-CH2-COONH4→H2N-CH2-COONH4+HCl→
→H2N-CH2-COOH+NH4Cl
Спочатку в цій реакції утворюється амонійна сіль амінокислоти, яка далі взаємодіє з хлороводнем, що утворюється в процесі реакції і перетворює дану сіль на амінокислоту.
4) Дія аміаку і синильної кислоти на альдегіди або кетони (реакція Штрекера). В умовах цієї реакції карбонільна сполука спочатку взаємодіє з аміаком і утворює імін, який потім приєднує ціан оводень і перетворюється таким чином на нітрил α-амінокислоти. Під час гідролізу такого нітрилу добувають α-амінокислоту:
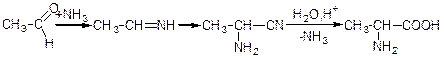
ацетальдімін нітрил амінопропіонової кислоти
5) Приєднання аміаку до ненасичених кислот. Цим методом отримують β-амінокислоти: дією аміаку в спиртовому розчині на α, β-ненасичені кислоти.
спирт
СH3-СH=CН-COOH+H2N-H → CH3-СH-СH2-COOH
 |
NH2
6) Відновлення оксидів або гідразонів відповідних альдегідо- і кетокислот:
а) 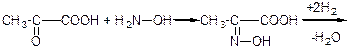
піровиноградна кислота гідроксил-амін оксим
→CH3-CH2-COOH
 |
NH2
аланін
б) 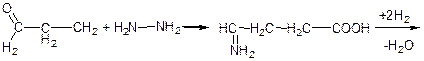
гідразин
→CH2-CH2-CH2-COOH
 |
NH2
γ-аміномасляна кислота
3. Фізичні властивості. Амінокислоти – безбарвні кристалічні речовини з високими температурами плавлення, які мало відрізняються для різних амінокислот. Тому t0пл. не є характерною константою для цих речовин. Під час плавлення амінокислоти переважно розкладаються. Більшість амінокислот добре розчиняється у воді, гірше – в органічних розчинниках. α-Амінокислоти L-ряду, що входять до складу білків, гіркі на смак або не мають його, а їх D-ізомери – солодкі на смак.
Хімічні властивості. Оскільки в молекулах амінокислот одночасно мстяться карбоксильна і амінна групи, то ці речовини виявляють властивості як кислот, так і амінів, тобто є амфотерними сполуками.
У водних розчинах кислотна й основна групи всередині молекул амінокислот взаємодіють одна з одною: йон вуглецю, що утворюються під час дисоціації карбоксильної групи, приєднується до азоту аміногрупи. Внаслідок цього в одній частині молекули амінокислоти утворюється амінна група з позитивним зарядом (катіон), а в другій – залишок карбоксильної групи з негативним зарядом (аніон). Завдяки цьому молекул амінокислот – біполярні йони або внутрішні солі:
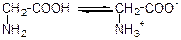
гліцин внутрішня сіль гліцину (біполярний іон)
Водні розчини одноосновних амінокислот мають нейтральну реакцію, так як вміщують однакову кількість СOO- и NH3-групи. Характер дисоціації амінокислот залежить від умов середовища. В кислому середовищі при надлишку йонів Н+(рН<7) біполярні Йони амінокислот перетворюються в їх амінні катіони, а у лужному середовищі при надлишку йонів Н-(рН>7) біполярні іони переходять в аніони:
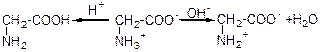
катіон гліцина аніон гліцина
Амінокислоти, завдяки своїй амфотерності, утворюють солі як з кислотами, так і з основами. В першому випадку в реакції приймає участь аміногрупа, а в другому – карбоксильна група.
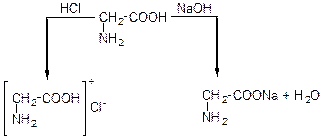
Хлористоводнева натрієва сіль гліцину
Сіль гліцину
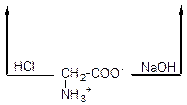
гліцин (внутрішня сіль)
Крім звичайних солей амінокислоти можуть утворювати внутрішньокомплексні солі з катіонами важких металів. Для всіх α-амінокислот характерні кристалізовані, інтенсивно забарвлені в синій колір комплексні солі міді:
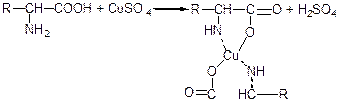
Реакції, що обумовлені карбоксильною групою амінокислот.
Подібно карбоновим кислотам амінокислоти за рахунок карбоксильної групи утворюють різноманітні похідні: солі, естери, хлорангідриди, аміди, тощо:
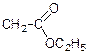

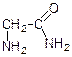
етиловий ефір гліцину хлорангідрид гліцину амід гліцину
Наприклад, ефіри амінокислот одержують під час взаємодії амінокислот зі спиртом в присутності хлористого водню:
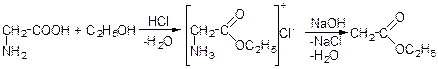
Таким чином характерні наступні реакції:
а) нейтралізації (взаємодія з лугом);
б) етерифікації;
в) галогенування.
Реакції, що обумовлені аміногрупою:
а) α-амінокислоти взаємодіють з азотистою кислотою подібно до первинних амінів: група NH2 заміщується групою -ОН, тобто амінокислоти перетворюються в оксикислоти:
СH3-СH-COOH+О=N-ОH→CH3-СH-COOH+N2+H2O
 |  |
NH2 ОН
α-амінопропіонова α-оксипропіонова
кислота кислота
б) Ацилування амінокислот.
Амінокислоти реагують з ангідридами та хлорангідридами кислот:
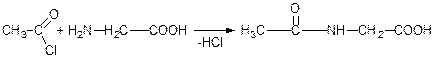
реакція Шоттен-Баума ацетилгліцин
в) Алкілування амінокислот:
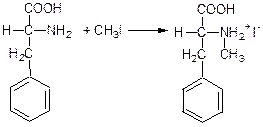
Утворюється амонієвий йон (відбувається кватернізація).
Реакції, що обумовлені взаємним впливом карбоксильної та аміногрупи.
1) Реакція з нингідрином.
Нингідрин – специфічний реактив на α-амінокислоти. Під час нагрівання його з α-амінокислотами виникає синьо-фіолетове забарвлення:
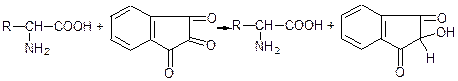
нингідрин
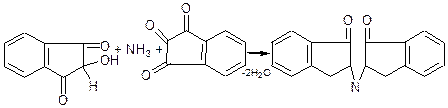
синьо-фіолетовий барвник
Тобто під дією t0 відбувається окислення NH2-групи до аміногрупи; кетогрупа відновлюється до ОН-групи; виділяється аміак.
Ця реакція має дуже велике аналітичне значення.
2) Перетворення амінокислот при нагріванні.
Залежно від взаємного розміщення аміногрупи і карбоксильної групи амінокислоти по-різному реагують на нагрівання, що використовують для встановлення їхньої будови.
α-Амінокислоти при нагріванні відщеплюють воду (міжмолекулярно) і утворюють циклічні аміди – дикетопіперазини:
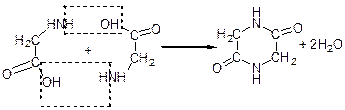
дикетопіперазин
β-амінокислоти при нагріванні відщеплюють аміак (внутрішньомолекулярно) за рахунок аміногрупи і атома водню СH2-групи, сусідньої з СООН-групою:
H2N-CH2-CH2-COOH→H2С=СH-COOH+NH3
γ-, δ- i ε-амiнокислоти при нагріванні відщеплюють воду (внутрішньомолекулярно) за рахунок зближених у просторі NH2- i COOH-груп. При цьому утворюються циклічні внутрішньо молекулярні аміди – лактами:
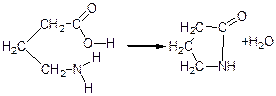
лактам γ-аміномасляної кислоти, бутиролактам
3) Утворення пептидів.
Пептиди – це аміди, що утворюються внаслідок взаємодії аміногруп і карбоксильних груп амінокислот. Амідна група

 -NH-C-
-NH-C-
O
у таких сполуках називається пептидним зв’язком. Залежно від кількості амінокислотних залишків у молекулі пептиди поділяють на дипептиди (два залишки амінокислот), три пептиди (три залишки) і т.д. до поліпептидів (багато залишків амінокислот).
Поліпептиди – пептиди з молекулярної масою до 10000, а пептиди з більшою молекулярною масою вважають білками.
Утворення пептидів розглядають як результат взаємодії карбоксильної групи однієї амінокислоти з амінною групою іншої:
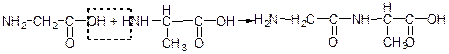
гліцин аланін дипептидгліцил-аланін
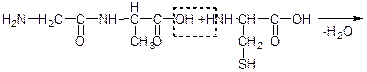
дипептид цистеїн
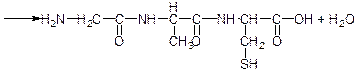
трипептид гліцин-аланіл-цистеїн
Назву пептидів утворюють з назв амінокислот, що входять до їх складу.
Білки являють собою природні полімери, дуже складні макромолекули яких побудовані з залишків α-амінокислот. Значення білків в природні виключно велике, так як ці речовини грають першочергову роль в усіх явищах життя. Найбільш повно значення білків для життєвих процесів сформулював Ф. Енгельс: «Скрізь, де ми зустрічаємо життя, ми знаходимо, що воно пов'язане з яким-небудь білковим тілом, і скрізь, де ми зустрічаємо яке-небудь білкове тіло, яке не знаходиться в процесі розкладу, ми без виключення зустрічаємо і явище життя. Життя є спосіб існування білкових тіл».
Рослини синтезують білки (і їх складові частини – α-амінокислоти) із СО2 і Н2О в результаті фотосинтезу, засвоюючи решту елементів білків (N, P, S, Fe, Mg) з розчинних солей, які знаходяться в ґрунті.
Особливо багато білків містять організми тварин і людини. Протоплазма і ядра живих клітин складаються в основному з білків. Велика кількість білків міститься в кістках, хрящах, м'язах, в нервових тканинах. З білків складається волосся, шерсть, пір'я, луска риби, копита, кігті, роги і т.д. Білки входять до складу крові, молока і т.д.
Тваринні організми в основному одержують готові амінокислоти з їжею і на їх базі будують білки свого організму. Деякі амінокислоти можуть синтезуватися в організмі тварин, такі кислоти називаються замінними. Інші не синтезуються тваринними організмами і повинні потрапляти з їжею – незамінні амінокислоти. В зв’язку з цим всі амінокислоти, що входять до складу природних білків розподіляються на дві групи. Тобто незамінні і замінні амінокислоти. До незамінних належать: валін, лейцин, лізин, гістидин. Повноцінна білкова їжа повинна обов’язково містити усі незамінні амінокислоти. Відсутність їх у їжі призводить до захворювань і загибелі тварини.
Класифікують білки на дві групи:
1) протеїни або прості білки, що складаються тільки з α-амінокислот і при гідролізі майже не утворюють інших продуктів;
2) протеїди або складні білки, які складаються з білкової частини, побудованої з α-амінокислот, і з з’єднаною з нею небілкової частини, При гідролізі ці білки, окрім α-амінокислот, утворюють і інші речовини: вуглеводні, фосфорну кислоту, гетероциклічні сполуки та ін.

 α-Амінокислоти, утворюючи білки, сполучаються за рахунок аміногруп і карбоксильних груп, утворюючи пептидні зв’язки -NH-C-
α-Амінокислоти, утворюючи білки, сполучаються за рахунок аміногруп і карбоксильних груп, утворюючи пептидні зв’язки -NH-C-
O
Так як макромолекули білків містять сотні амінокислотних ланок, причому одна і таж сама амінокислота може входити в ланцюг не один, а декілька разів, то можна зробити висновок про безмежні властивості в побудові пептидних ланцюгів білкових молекул. З цього випливає, що природа білка визначається не тільки тим, які амінокислоти входять до його складу, а особливо тим, в якій послідовності вони з’єднуються одна з одною.
Послідовність амінокислотних залишків в поліпептидному ланцюгу називається первинною структурою білка. Вона суворо специфічна для білків.
Поліпептидні ланцюги містять безліч бічних розгалужень, тобто тих частин амінокислотних залишків, які безпосередньо до ланцюга не входять. Щоб це пояснити, уявімо собі деякий відрізок поліпептидного ланцюга білкової молекули. Складеної з залишків різних α-амінокислот, наприклад:
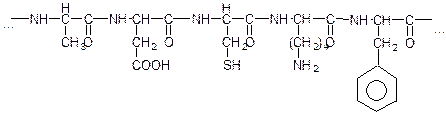
залишок аспарагінової цистеїн залишок залишок
аланіну кислоти лізину фенілаланіну
З цього прикладу видно, що бічні відгалуження можуть містити різноманітні функціональні групи (-СООН, -NH2, -OH, -SH, 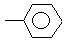 та ін.), деякі можуть взаємодіяти одна з одною. Тому молекули багатьох білків складаються не з однієї, а з декількох поліпептидних ланцюгів. Між функціональними групами утворюються також водневі і дисульфідні зв’язки. Характерна особливість поліпептидних ланцюгів білків – схильність закручуватись і спіралі. Виникнення між окремими ділянками спіралі водневих зв’язків надає їй стійкості. Спіральна скрученість поліпептидних ланцюгів називається вторинною структурою білка.
та ін.), деякі можуть взаємодіяти одна з одною. Тому молекули багатьох білків складаються не з однієї, а з декількох поліпептидних ланцюгів. Між функціональними групами утворюються також водневі і дисульфідні зв’язки. Характерна особливість поліпептидних ланцюгів білків – схильність закручуватись і спіралі. Виникнення між окремими ділянками спіралі водневих зв’язків надає їй стійкості. Спіральна скрученість поліпептидних ланцюгів називається вторинною структурою білка.
Спіралі вторинної структури можуть різними способами загинатись і складатись, утворюючі своєрідні клубки, таким чином створюється третинна структура білка. Вона стабілізується зв’язками різного типу: водневими, дисульфідними -S-S- амідними -NH-CO-, що виникають між окремими ділянками спіралі за рахунок функціональних груп в бічних відгалуженнях. Четвертинну структури утворюють клубки декількох поліпептидних молекул.
Білкові речовини різноманітні за своїм агрегатним станом. Частина – це тверді аморфні тіла у вигляді білих порошків. Деякі білки отримані в кристалічному стані (гемоглобін крові). Білки шерсті і шовку – міцні волокна. Багато білків мають консистенцію в’язких рідин чи студенів.
Білки нерозчинні в органічних розчинниках. Багато білків розчиняються у воді і в розбавлених розчинах солей, але утворюють не істинні, а колоїдні розчини.
При додаванні до водних розчинів білків концентрованих розчинів мінеральних солей білки осаджуються – висолювання. Осадження їх відбувається і при додаванні органічних розчинників (спирту, ацетону). В усіх цих випадках білки не змінюють своїх властивостей і при розбавленні водою знову переходять в розчин.
При нагріванні багато білків звертаються і теж осаджуються з розчинів, втрачаючи здібність розчинятись у воді – денатурація.
Якісними реакціями на білки є:
а) біуретова реакція – поява фіолетового забарвлення при обробці солями міді в лужному середовищі. Цю реакцію дають всі білки;
б) ксантопротеїнова реакція – поява при дії концентрованої азотної кислоти жовтого забарвлення, яке при дії аміаку переходить в оранжеве. Слід відмітити, що ксантопротеїнову реакцію дають тільки ті білки, які містять угрупування ароматичних сполук (жовте забарвлення мають ароматичні нітросполуки, що утворюються);
в) нингідридна реакція – поява синього забарвлення при кип’ятінні з водним розчином нингідриду.
Для нормального функціонування тваринний організм, в тому числі і організм людини, повинен щоденно, окрім води і неорганічних солей, отримувати з їжею білки, вуглеводи, жири. В добовому білковому раціоні людина повинна отримувати 21-31 г незамінних амінокислот. Їжа, навіть та, що містить значну кількість білків, може бути неповноцінною, якщо в цих білках немає необхідного набору незамінних амінокислот. Найбільш повноцінні по амінокислотному складу білки тваринних продуктів (м'яса, яєць і т.п.).
Для рослинних білків характерна недостача незамінних амінокислот, наприклад, пшенична мука містить тільки 1/3 частини необхідного лізину; в сої мало лейцину; в горосі - триптофану. Додаючи до рослинних продуктів синтетичні незамінні амінокислоти вирівнюють їх поживність з поживною цінністю тваринних продуктів. Білки звичайно безбарвні, не мають запаху і смаку. Тому практично неможливо включити ізольовані білки в раціон харчування людини. Тому одним із шляхів використання білків є застосування їх як домішку до традиційних харчових продуктів. Останні роки все більшого значення набуває якісно новий напрямок у виробництві їжі. Він полягає в переробці білків різного походження в штучні продукти харчування. Штучний синтез білкових харчових продуктів повинен включати слідуючи етапи:
1) багатотоннажний дешевий метод синтезу крайньою мірою незамінних α-амінокислот;
2) виділення L-ізомерів з рацемічної суміші;
3) структуризація їжі (желе, ікра і т.д.) і надання їй первинного кольору і запаху.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 6450; Нарушение авторских прав?; Мы поможем в написании вашей работы!