
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекція № 30-31
|
|
|
|
Список рекомендованої літератури
Список використаної літератури
1. Большая психологическая энциклопедия. – М.: Эксмо, 2007. – 544 с.
2. Збірник завдань із загальної психології / За ред. проф. В.С. Мерліна. – К.: Вища школа, 1977. – 231 с.
3. Казаков В.Г., Кондратьева Л.Л. Психология: Учебн. для индустр.-пед. техникумов. – М.: Высш. шк., 1989. – 383 с.
4. М’ясоїд П.А. Загальна психологія: Навч. посіб. – 3-є вид., випр. – К.: Вищ. шк., 2004. – 487 с.
5. Немов Р.С. Психология: Ученик для студ. высш. пед. учеб. заведений: В 3-х кн. – Кн. 1: Общие основы психологии. – 4-е изд. – М.: Владос, 2001. – 688 с.
6. Пашукова Т.І., Допіра А.І., Дьяконов Г.В. Практикум із загальної психології / За ред. Т.І. Пашукової. – К.: Т-во «Знання», КОО, 2000. – 204 с.
7. Платонов К.К. Занимательная психология. – М.: Молодая гвардия, 1964. – 384 с.
8. Психологія: конспект лекцій для студентів: Метод. посіб. / Мартинюк І.А., Полозенко О.В., Стахневич В.І. та ін. – К.: НАУ, 2006. – 80 с.
9. Шостак В.І. Природа наших відчуттів. – К.: Рад. шк., 1989. – 118 с.
10. Штейнмец А.Э. Пособие для самостоятельной работы по общей
психологии: Учеб. пособие. – Смоленск: СГПИ им. К. Маркса,
1986. – 80 с.
1. Большая психологическая энциклопедия. – М.: Эксмо, 2007. – 544 с.
2. Загальна психологія: Навч. посібник / О. Скрипченко, Л. Долинська, З. Огороднійчук та ін. – К.: Просвіта, 2005. – 464 с.
3. Загальна психологія: Підручник для студентів вищ. навч. закладів / С.Д. Максименко, В.О. Зайчук, В.В. Клименко, В.О. Соловієнко. За заг. ред. С.Д. Максименка. – К.: Форум, 2000. – 543 с.
4. Казаков В.Г., Кондратьева Л.Л. Психология: Учебн. для индустр.-пед. техникумов. – М.: Высшая шк., 1989. – 383 с.
5. Кондаков И.М. Психология. Иллюстрированный словарь / И.М. Кондаков. – 2-е изд., доп. и перераб. – СПб.: ПРАЙМ- ЕВРОЗНАК, 2007. – 783 с.
6. Короткий психологічний словник / За ред. проф. В.І. Войтко. – К.: Вища школа, 1976. – 191 с.
7. М’ясоїд П.А. Загальна психологія: Навч. посіб. – 3-є вид., випр. – К.: Вища шк., 2004. – 487 с.
8. Маклаков А.Г. Общая психология: Учебник для вузов. – СПб.: Питер, 2005. – 583 с.
9. Маркосян А.А. Физиология. – М.: Медицина, 1975. – 351 с.
10. Немов Р.С. Психология: Ученик для студ. высш. пед. учеб. заведений: В 3-х кн. – Кн. 1: Общие основы психологии. – М.: Владос, 2001. – 688 с.
11. Общая психология. Курс лекций / Сост. Е.И. Рогов. – М.: ВЛАДОС, 1995. – С. 81-86.
12. Общая психология: Учеб. для студ. пед. ин-тов / А.В. Петровский, А.В. Брушлинский, В.П. Зинченко и др.; Под ред. А.В. Петровского. – М.: Просвещение, 1986. – 464 с.
13. Психологія: конспект лекцій для студентів: Метод. посіб. / Мартинюк І.А., Полозенко О.В., Стахневич В.І. та ін. – К.: НАУ, 2006. – 80 с.
14. Психологія: Навч. посіб. / О.В. Винославська, О.А. Брусенко. – К.: ІНКОС, 2005. – 352 с.
15. Психологія / Ю.Л. Трофімов, В.В. Рибалка, П.А. Гончарук. – К.: Либідь, 2003. – 560 с.
16. Современный психологический словарь / Под ред. Б.Г. Мещерякова, В.П. Зинченко. – СПб.: ПРАЙМ-ЕВРО-ЗНАК, 2007. – 490 с.
17. Столяренко Л.Д., Самыгин С.И. 100 экзаменационных ответов по психологии. – Ростов н/Д: Изд. центр «МарТ», 2001. – 256 с.
18. Шостак В.І. Природа наших відчуттів. – К.: Рад. шк., 1989. – 118 с.
Тема: Деякі поняття фізичної органічної хімії
План
1. Зв'язок складу та будови сполук з фізичними властивостями.
2. Ідентифікація органічних сполук.
Вуглеводні складу 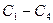 - гази;
- гази;  - рідини;
- рідини;  та вищі – тверді речовини, парафіни. При додаванні до вуглецевого ланцюга метиленової різниці
та вищі – тверді речовини, парафіни. При додаванні до вуглецевого ланцюга метиленової різниці 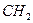 температура кипіння підвищується на
температура кипіння підвищується на  . Найбільш високі температури кипіння та щільність спостерігається в ряду ізомерів, які мають нормальну будову вуглецевого радикалу. Це пояснюється більш щільним “пакуванням” молекул. Парафінові вуглеводні нормальної будови утворюють кватратні сполуки зі сечовиною, вони завантажують кристалічну решітку – для виділення нормальних вуглеводнів та їх похідних від близьких за будовою сполук. З розгалуженою будовою нормальні вуглеводні кристалізуються з сечовиною зі спиртів та ацетоні. Починаючи з пентану та бутилу, ненасичені вуглеводні – рідини. Введення в вуглеводневі ланцюги замісників, які містять гетероатоми значно змінює фізичні властивості речовин. У зв’язку із підвищеною полярністю зв’язків і молекул взагалі посилює міжмолекулярну взаємодію. Особливо це спостерігається під час утворення міжмолекулярних водневих зв’язків, введення карбоксильних, гідроксильних і аміногруп.
. Найбільш високі температури кипіння та щільність спостерігається в ряду ізомерів, які мають нормальну будову вуглецевого радикалу. Це пояснюється більш щільним “пакуванням” молекул. Парафінові вуглеводні нормальної будови утворюють кватратні сполуки зі сечовиною, вони завантажують кристалічну решітку – для виділення нормальних вуглеводнів та їх похідних від близьких за будовою сполук. З розгалуженою будовою нормальні вуглеводні кристалізуються з сечовиною зі спиртів та ацетоні. Починаючи з пентану та бутилу, ненасичені вуглеводні – рідини. Введення в вуглеводневі ланцюги замісників, які містять гетероатоми значно змінює фізичні властивості речовин. У зв’язку із підвищеною полярністю зв’язків і молекул взагалі посилює міжмолекулярну взаємодію. Особливо це спостерігається під час утворення міжмолекулярних водневих зв’язків, введення карбоксильних, гідроксильних і аміногруп.
Температури кипіння органічних речовин різної будови:
| Формула | Назва речовини | t кип., |

| етан | -88 |

| диметиловий ефір | -24 |

| диетиловий ефір | |
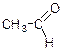
| ацетальдегід | |
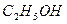
| етанол | |

| оцтова кислота | |
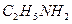
| етиламін | |
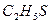
| етантіол | |

| ацетонітрил | - |
Дипольні моменти деяких органічних сполук:
диетиловий естер: 
оцтовий альдегід: 
етанол: 
Меркаптани – мало асоційовані сполуки, киплять при більш низьких температурах. Висока полярність та можливість утворювати водневі зв’язки обумовлені доброю розчинністю речовин у більшості розчинників. Особливо це стосується тих сполук, які можуть утворювати водневі комплексні: воду, спирти, кислоти.
Розгалуження карбонового скелету в ряду ізомерних похідних вуглеводнів знижує температуру кипіння.
Температура кипіння спиртів різної будови:
| Формула | Назва спирту | 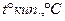
|

| первинний бутиловий | |
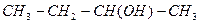
| вторинний бутиловий | |
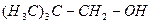
| третинний бутиловий | |
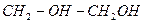
| етиленгліколь | |

| гліцерин |
Розгалуження алкільного радикалу молекули спирту екранує гідроксильну групу та зменшує ступінь можливості утворення водневих зв’язків.
Нижчі представники спиртів, кислот, альдегідів, кетонів, амінів, розчинні у воді у зв’язку з тим, що функціональна група має значний внесок.
Зі збільшенням алкільного радикалу розчинність зменшується.
Високомолекулярні похідні близькі за своїми властивостями до відповідних алканів: нерозчинні у воді та багатьох органічних розчинниках. Введення в алкани та алкени галогенів призводить до різкого підвищення щільності та температур кипіння.
Хлороформ і тетрахлоркарбон – важкі рідини, їх щільність: 1,498 та1,595. Температура кипіння галогеналканів підвищується зі збільшенням карбонового ланцюга та накопичення в молекулі атомів галогену (підвищується атомна маса). Наприклад, бромоформ важче хлороформу.
1. Ідентифікація органічних сполук.
Найчастіше дана речовина вже відома. Якщо синтезуємо сполуку, її треба ідентифікувати за трьома параметрами:
1) температурою кипіння;
2) коефіцієнтом заломлення;
3) щільністю (ρ або D).
В деяких випадках, особливо стосовно нових сполук, визначають молекулярну масу. Для твердої речовини достатньо ідентифікувати через  яка не змінюється після повторної кристалізації, при відсутності депресії (змінюється
яка не змінюється після повторної кристалізації, при відсутності депресії (змінюється  ), проби змішування синтезованої речовини з вже відомими продуктами.
), проби змішування синтезованої речовини з вже відомими продуктами.
Для встановлення будови також можна використовувати хід самого синтезу, зустрічний синтез (незалежний) та хімічні перетворення отриманої речовини.
Перед тим, як приступати до ідентифікації хімічної речовини, необхідно її ретельно почистити. Для рідинних продуктів використовують перегонку (звичайний тиск або вакуум). Використання вакууму дозволяє знизити  високо киплячої речовини (
високо киплячої речовини (
 100
100 ), щоб зменшити ступінь розкладання. Тверді речовини очищують під час кристалізації екстракцією або воронкою.
), щоб зменшити ступінь розкладання. Тверді речовини очищують під час кристалізації екстракцією або воронкою.
У лабораторній практиці для розділення й очищення речовин часто використовують колон очну хроматографію, газорідинну, рідинну хроматографію на папері або на пластині.
Молекулярну масу визначають за методом мас-спектрометрії: здійснюють елементарний аналіз речовин на основі даних про масову долю карбону, кисню, сірки, галогену і виводять футоформулу. З метою визначення будови речовин проводять функціональний аналіз. Існує багато різноманітних хімічних методів якісного та кількісного аналізу різних функціональних груп: гідроксильної, карбоксильної, епоксидної, амінної, кратних зв’язків. На сьогоднішній час для встановлення кількісного складу та структури речовини (це стосується тонких стереохімічних особливостей) найбільш важливими є спектроскопічні методи: ІЧ- та УФ –спектроскопії, спектроскопія ядерного магнітного резонансу (ЯМЗ), спектроскопія електронного парамагнітного резонансу (ЕПР), мас – спектроскопія.
Оптична спектроскопія. ІЧ спектроскопія використовується в діапазоні 4000 – 500 см . ІЧ спектроскопію використовують для ідентифікації, встановлення будови та кількісного визначення речовини, оскільки ІЧ-спектри мають багато смуг поглинання, які характеризують кожний тип зв’язку або функціональну групу. Метод ґрунтується на вивченні коливальних та обертальних спектрів поглинання в ІЧ-ділянці спектра. Виникнення спектру поглинання в ІЧ-ділянці 400 – 600см
. ІЧ спектроскопію використовують для ідентифікації, встановлення будови та кількісного визначення речовини, оскільки ІЧ-спектри мають багато смуг поглинання, які характеризують кожний тип зв’язку або функціональну групу. Метод ґрунтується на вивченні коливальних та обертальних спектрів поглинання в ІЧ-ділянці спектра. Виникнення спектру поглинання в ІЧ-ділянці 400 – 600см (λ=2,5-167 мкм) пов’язане з коливаннями атомів у молекулі, тобто ІЧ-спектри зумовлені переходом між двома коливальними рівнями молекул. У спектрі виявляють коливання, що супроводжуються зміною моменту молекули.
(λ=2,5-167 мкм) пов’язане з коливаннями атомів у молекулі, тобто ІЧ-спектри зумовлені переходом між двома коливальними рівнями молекул. У спектрі виявляють коливання, що супроводжуються зміною моменту молекули.
Експериментальні дослідження значної кількості речовин, молекули яких містять однакові хімічні групи, показують, що вони поглинають ІЧ-промені у вузькому інтервалі частот (називається характеристичними або груповими: 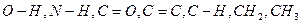 ).Зокрема, характеристичними є коливання груп, що містять легкий атом гідрогену або квадратні зв’язки.
).Зокрема, характеристичними є коливання груп, що містять легкий атом гідрогену або квадратні зв’язки.
Групи, що складаються з атомів, близьких за масою або містять хімічні зв’язки, що мають однакові силові коефіцієнти, не містять характерних смуг поглинання в ІЧ-ділянці спектра.
Коливання, за яких змінюється довжина зв’язків є валентними коливаннями і позначаються ν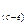 . Якщо під дією ІЧ-випромінювання змінюються кути між зв’язками, такі коливання називають деформуючими і позначають літерою δ Кожна хімічна сполука має свій характерний спектр поглинання.
. Якщо під дією ІЧ-випромінювання змінюються кути між зв’язками, такі коливання називають деформуючими і позначають літерою δ Кожна хімічна сполука має свій характерний спектр поглинання.
Характеристичні частоти оглинання
| Функціональна група | Клас сполуки | ν, см
| Інтенсивність | |

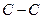
| Алкани | 2850-2960 600-1500 | сильна слабка | |

| Алкени | 1620-1680 | змінна | |
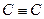
| Алкіни | 2100-2260 | змінна | |
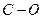
| Оксирани ефіріи, спирти | 2000-1300 | сильна | |
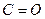
| Альдегіди, кислоти | 1705-1740 1700-1750 | сильна сильна | |

| Спирти, феноли, кислоти | 3590-3650 асоційовані 3200-3400 3500-3000 асоційовані | змінна вузька сильна широка змінна широка | |

| Аміни | 3400-350 | сильна, подвійний пік | |

| Аміди, N-звміщені аміди, вторинні | 3300-3400 3280-3500 | сильна, одинарний пік | |

| Алкілхлориди Актилброміди | 550-850 | середня середня | |

| Меркаптани | 650-750 | ||

| Меркапто | 2550+50 | ||
Частоти кістякових коливань органічних молекул звичайно доводяться на область 1400-1700 см , і часто важко приписати окремі частоти якому-небудь із можливих для молекул коливань, хоча сукупність смуг досить однозначно вказує на приналежність до певної молекулярної структури. У таких випадках смуги “називають відбитками пальців“ молекули в спектрі.
, і часто важко приписати окремі частоти якому-небудь із можливих для молекул коливань, хоча сукупність смуг досить однозначно вказує на приналежність до певної молекулярної структури. У таких випадках смуги “називають відбитками пальців“ молекули в спектрі.
Таким чином ІЧ–спектри дозволяють казати про присутність або відсутність в молекулі тих або ін.. груп і функціональних угруповань, про особливості їх розташування у просторі, а також, в деяких випадках, про екзо- та ендомолекулярну взаємодію.
Добрим доповнюючим методом є спектроскопія комбінаційного розсіювання (КР). КР – спектри дають можливість ідентифікувати за інформацією про симетричні валентні коливання в симетричній молекулі (етилен, циклогексан).
Спектроскопія ЯМР заснована на можливості деяких ядер атомів, які володіють спиновим магнітним елементом, поглинати кванти випромінювання радіохвильового діапазону. Такими властивостями володіють ядра атомів з масою, яка виражена непарним числом: 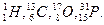 , ядра з непарними порядковими номерами і масою, що виражена парним числом:
, ядра з непарними порядковими номерами і масою, що виражена парним числом: 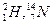 .
.
Найбільш широке застосування отримала спектроскопія ПМР (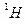 , часто використовують
, часто використовують  ).
).
Мас-спектрометрія.
В газовому стані молекула починає атакуватися пучком електронів середніх енергій (30 еВ). Атака може бути (70 еВ) швидколетючими електронами. Молекула стає позитивно зарядженою - М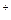 (молекулярний йон).
(молекулярний йон).
При високому бомбардуванні молекула розкладається. Цей метод єдиний, який приводить до деструкцій молекул.
Література
1. Степаненко Б.Н. Курс органической химии. (в 2-х частях), ч. 2. Карбоциклические и гетероциклические соединения. Учеб. для вузов. 6-е перер. и доп. М.: Высшая школа. 1981.
2. Тейлор Г. Основы органической химии для студентов нехимических специальностей./ пер. с англ. Е.Д./ М.: Мир. 1989.
3. Черных В.П., Зименковский Б.С., Гриценко И.С. Органическая химия. В 3-х томах. Харьков: Основа. 1993, 1995, 1998.
4. Домбровський А.В. Органічна хімія. Навч. посіб. – К.: Вища школа. 1991
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 418; Нарушение авторских прав?; Мы поможем в написании вашей работы!