
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Біологічна роль та використання вуглеводів
|
|
|
|
Біологічна роль вуглеводів в організмі людини досить різноманітна.
1. Енергетична роль є основною, бо вуглеводи на 55–60 % покривають енергетичні витрати організму. Цю роль виконують глюкоза, фруктоза та глікоген. Під час окиснення 1 г вуглеводів до С02 та Н20 утворюється 4,1 ккал (17 кДж) енергії. Складні вуглеводи у вигляді глікогену, що відкладається в печінці, скелетних м'язах та інших тканинах, створюють запас поживних речовин, тобто енергетичний резерв організму.
2. Пластична функція вуглеводів полягає в тому, що вони використовуються для побудови АТФ та інших нуклеотидів (рибоза), нуклеїнових кислот – РНК (рибоза) та ДНК (дезоксирибоза), складних білків (глікопротеїди), клітинних мембран, скелету та хрящів.
3. Захисна роль вуглеводів пов'язана з мукополісахаридами, що входять до складу слизу носової порожнини та інших оболонок і захищають від проникнення вірусів, пилу, а також гепарином, що знаходиться у крові та тромбоцитах і запобігає утворенню кров'яних зсідків. Вуглеводи входять до компонентів імунної системи.
4. Специфічна роль вуглеводів полягає в тому, що вони входять до складу компонентів групи крові, рецепторів окремих гормонів. Цікавим є те, що у медичній практиці розчин полісахариду декстрину, який утворюють мікроорганізми, використовується як замінник плазми крові при кровотечах, оскільки він за в'язкістю близький до крові.
5. Регуляторну роль виконують клітковина (целюлоза), а також пектинові речовини. У системі травлення вони не розщеплюються, але регулюють перистальтику кишечнику та активність ферментів; пектини добре виводять шлаки.
Використання вуглеводів в медицині:
1. Використовують 5 % розчин глюкози;
2. Сінкол – замінник крові;
3. Група глікозидів – серцеві препарати.
ХІМІЧНЕ ПЕРЕТВОРЕННЯ ВУГЛЕВОДІВ ІЖІ У ТРАВНІЙ СИСТЕМІ
Прості вуглеводи, зокрема моносахариди, не розщеплюються у травній системі і швидко всмоктуються в тонкому кишечнику. Їх рівень в крові підвищується уже за 15–20 хв після прийому їжі. Дисахариди розпадаються на моносахариди в тонкому кишечнику під дією специфічних ферментів: сахарази, лактази та мальтази. Надходження великої кількості моно- та дисахаридів (більше 150 г) викликає стан гіперглікемії, що активує підшлункову залозу, тому в харчовому раціоні простих вуглеводів має бути 25–35 % норми.
Складні вуглеводи їжі (в основному крохмаль) частково розщеплюються уже в ротовій порожнині під дією ферментів слини амілази та мальтази, високоактивних у слабколужному середовищі. Амілаза розщеплює крохмаль та глікоген, а мальтаза – мальтозу. При цьому утворюються низькомолекулярні вуглеводи – декстрини, частково також – мальтоза та глюкоза.
У шлунку розщеплення вуглеводів їжі не відбувається, оскільки відсутні специфічні ферменти гідролізу вуглеводів, а кисле середовище шлункового соку (рН 1,5–2,0) пригнічує активність ферментів слини.
У тонкому кишечнику відбувається основний розпад складних вуглеводів їжі під дією ферменту амілази соку підшлункової залози та високоспецифічних ферментів кишечнику (мальтаза, сахараза і лактаза) до моносахаридів, в основному глюкози, фруктози та галактози.
Крохмаль їжі повільно розщеплюється у травній системі. Підвищення рівня глюкози в крові починається через 2–3 год після прийому їжі.
Клітковина (целюлоза), якої в організм людини надходить велика кількість з овочами та фруктами, у тонкому кишечнику не розщеплюється через відсутність ферментів. Часткове розщеплення її відбувається до целобіози та глюкози у товстому кишечнику під дією бактеріальних ферментів.
Всмоктування (проникнення через стінки кишечнику та кровоносні капіляри) утворених моносахаридів глюкози, фруктози в кров відбувається шляхом активного АТФ-залежного транспорту з участю білка-переносника та градієнта концентрації Na+. Наявність у кишечнику іонів Na+ викликає активацію АТФази та розпад АТФ, енергія якої використовується для проникнення моносахаридів через стінки кишечнику. Всмоктування інших речовин відбувається за допомогою дифузії, оскільки їх концентрація у крові низька, а в кишечнику висока.
Процес всмоктування моносахаридів у кишечнику регулюється нервовою та гормональною системами. Під дією нервової системи може змінюватися проникність кишкового епітелію, ступінь кровопостачання слизової оболонки шлункової стінки та швидкість руху ворсинок кишечнику, в результаті чого змінюється швидкість всмоктування моносахаридів у кров. Всмоктування глюкози активується гормонами кіркової речовини надниркових залоз, гіпофізу, щитоподібної та підшлункової залоз і пригнічується адреналіном, гормоном мозкової речовини надниркових залоз.
Інтенсивна м'язова діяльність уповільнює всмоктування вуглеводів, а легка і нетривала робота посилює цей процес. Підвищення температури навколишнього середовища до 35–40 °С пригнічує, а зниження нижче 25 °С посилює всмоктування вуглеводів, що пов'язано, очевидно, зі стимуляцією енергетичного обміну.
РІВЕНЬ ГЛЮКОЗИ У КРОВІ ТА МЕХАНІЗМИ РЕГУЛЯЦІЇ ЙОГО СТАЛОСТІ
Концентрація глюкози в крові дорослої людини у нормі підтримується у межах 3,5–6,0ммоль-л-1 (80–120мг % – на 100мл)незважаючи на різну кількість її вживання та окиснення тканинами протягом дня її рівень у крові регулюється печінкою та гормональною і нервовою системами.
Печінка відіграє найважливішу роль в регуляції рівня глюкози в крові. Вона може поглинати або виділяти глюкозу в кров залежно від її концентрації в ній, а також синтезувати із речовин не вуглеводної природи в процесі глюконеогенезу.
При підвищенні глюкози в крові, зокрема після прийому вуглеводної їжі, активується ферментативний процес синтезу глікогену, вона надходить у печінку, де відбувається депонування вуглеводів. При зниженні її рівня в крові підсилюється розпад глікогену в печінці та виділення глюкози в кров (мобілізація вуглеводів). Вміст глікогену в печінці значно знижується під час голодування (наприклад після нічного сну) чи після тривалої 1–2 год фізичної роботи.
Основними гормонами, що регулюють рівень глюкози в крові і підтримують його сталість, є гормони підшлункової залози – інсулін та глюкагон. Інсулін знижує рівень глюкози в крові, коли він підвищений, збільшуючи проникність її через мембрани клітин скелетних м'язів та жирової тканини, що активує синтез глікогену або жиру (у жировій тканині) та їх депонування. Регуляторна дія інсуліну забезпечується завдяки взаємодії його з інсулін-чутливими рецепторами, які є на поверхні мембран інсулін-чутливих тканин. Глюкагон підвищує рівень глюкози в крові шляхом активування розпаду глікогену (мобілізації) у печінці і виділення глюкози у кров. Подібну до глюкагону дію виконують адреналін, норадреналін, тироксин та інші гормони. Виділення цих гормонів регулюється ЦНС.
У разі значного надходження вуглеводів з їжею або інтенсивного розпаду глікогену в печінці рівень глюкози в крові може зростати до 10 ммоль-л-1 і вище, що характеризується як стан гіперглікемії. Якщо концентрація глюкози в крові досягає 9–10 ммоль-л-1 нирки не утримують її (нирковий "бар'єр" для глюкози) і вона з'являється в сечі. Такий стан називають глюкозурією. Гіперглікемія може виникати і за умов зниженого використання глюкози тканинами, що найчастіше спостерігається при важкому захворюванні – цукровому діабеті. Пов'язане це захворювання або з порушенням біосинтезу гормону підшлункової залози інсуліну (гіпофункція), який регулює проникнення глюкози у тканини (інсулінозалежна форма цукрового діабету), або із втратою чутливості тканинних рецепторів до інсуліну (інсулінонезалежна форма). Оскільки захворювання цукровим діабетом супроводжується, в першу чергу, підвищеним рівнем глюкози в крові (гіперглікемією) і часто своєчасно не виявляється, необхідно знати симптоми, що спостерігаються у людини при цьому. Симптоми, що спостерігаються у разі гіперглікемії, а також гіпоглікемії подано на рис. 15.

Тимчасове підвищення глюкози у крові може спостерігатись одразу після приймання їжі, насиченої простими вуглеводами (150–200 г цукру), що називають аліментарною гіперглікемією. Через 2–3 год після цього вміст глюкози в крові нормалізується. Стан гіперглікемії може спостерігатися у деяких спортсменів перед стартом та в перші хвилини інтенсивної роботи, коли швидкість розпаду глікогену в печінці збільшується у 7–10 разів. Це поліпшує виконання нетривалих фізичних навантажень, але погіршує виконання тривалої роботи.
Зниження рівня глюкози у крові до 3 ммоль-л-1 і нижче (гіпоглікемія) спостерігається рідко, оскільки організм може синтезувати глюкозу з амінокислот та метаболітів обміну жирів у процесі глюконеогенезу. Гіпоглікемія може виникнути під час напруженої тривалої фізичної роботи або тривалого голодування через вичерпання запасів вуглеводів у печінці. Вона спричиняє порушення діяльності мозку, еритроцитів, нирок, для яких глюкоза є головним енергетичним субстратом. При цьому можливі порушення діяльності ЦНС, втрата свідомості (гіпоглікемічна кома) або навіть настання смерті (див. рис. 15). Для запобігання такого стану під час тривалої роботи спортсмени використовують додаткове вуглеводне харчування. Прийом вуглеводів під час фізичних навантажень сповільнює вичерпання запасів глікогену в працюючих м'язах і збільшує тривалість виконаної роботи (Мохан и др., 2001).
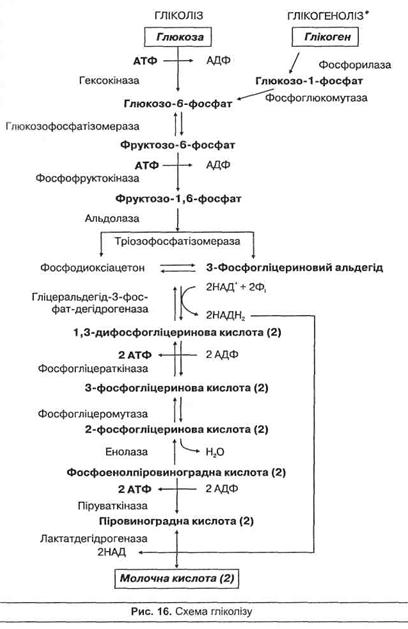
АНАЕРОБНЕ ОКИСНЕННЯ ВУГЛЕВОДІВ
У тканинах організму людини вуглеводи постійно розпадаються та окиснюються, що супроводжується виділенням енергії. Можливі два основні механізми окиснення вуглеводів – анаеробний (без участі кисню) та аеробний (з участю кисню).
Анаеробне окиснення вуглеводів називають гліколізом. Гліколіз – це процес поступового розпаду молекули глюкози або глікогену (глікогеноліз) до двох молекул піровиноградної кислоти (пірувату), що в анаеробних умовах перетворюється на молочну кислоту. Цей процес відбувається у скелетних м'язах і призводить до накопичення молочної кислоти та відновлення АТФ, а також виділення теплової енергії, згідно зі схемою рівняння: глікоген -> глюкоза -> 2СН3СНОНСООН + 3 або 2АТФ.
Починається гліколіз або з активації молекули глюкози під час взаємодії з АТФ, що веде до утворення глюкозо-6-фосфату, або з розщеплення глікогену з участю ферменту фосфорилази (глікоген-фосфорилази) з утворенням глюкозо-1 -фосфату, що швидко перетворюється в глюкозо-6-фосфат без участі АТФ. Схему гліколізу та глікогенолізу подано на рис. 16. Гліколіз включає дві основні стадії – підготовчу та окиснювальну. В підготовчій стадії молекула глюкози поступово розпадається до двох молекул 3-фосфогліцеринового альдегіду, при цьому використовуються дві молекули АТФ. У процесі глікогенолізу використовується лише одна молекула АТФ, тому що до глюкози приєднується Н3Р04. В окиснювальній стадії відбувається подальше окиснення метаболіту з утворенням пірувату та чотирьох молекул АТФ, атакож 2 молекул відновленого НАДН.
Гліколіз в анаеробних умовах завершується реакцією відновлення піровиноградної кислоти до молочної під дією ферменту лактат-дегідрогенази. Джерелом гідрогена слугують молекули НАДН, що утворюються при окисненні 3-фосфогліцеринового альдегіду. При цьому утворюється НАД, що знову включається в гліколіз. Таким чином, кінцевим продуктом анаеробного гліколізу є молочна кислота. В аеробних умовах піровиноградна кислота перетворюється в ацетил-КоА, котрий далі окиснюється у циклі лимонної кислоти до кінцевих продуктів обміну.
Ефективність утворення корисної енергії у формі АТФ під час гліколізу становить лише 40 %. Основна частина енергії, що акумульована у молекулі глюкози, залишається у продукті гліколізу – двох молекулах молочної кислоти – може вивільнятися лише у разі їх подальшого аеробного окиснення.
Гліколіз і глікогеноліз забезпечують енергією виконання інтенсивної (анаеробної) роботи від 30 с до 2-5 хв, дозволяють розвинути високий темп роботи до того часу, поки серцево-судинна система не вийде на максимальне функціонування, що відбувається після 1–2 хв роботи чи навіть пізніше. Потрібно звернути увагу на те, що гліколіз більше характерний для II типу м'язових волокон, що швидко скорочуються, де висока активність ферментів цього процесу.
Гліколіз відбувається також у м'язах за їх гіпоксичного стану (нестача кисню), викликаного патологічними змінами метаболізму чи фізіологічних систем, за умов перебування на високогір'ї тощо.
АЕРОБНЕ ОКИСНЕННЯ ВУГЛЕВОДІВ
Аеробне окиснення глюкози – це багатостадійний процес розпаду її молекули до кінцевих продуктів обміну С02 і Н20 з утворенням 38 молекул АТФ і виділенням теплової енергії. Відбувається він зучастю кисню, який доставляється до тканин білком гемоглобіном і І шляхом дифузії проникає у мітохондрії, де використовується як акцептор водню (див. розділ 5).
Загальне спрощене рівняння аеробного окиснення глюкози таке:с6н12о6+ 6о2~> 6С02 + 6Н20 + 38АТФ.
З цього рівняння можна вирахувати дихальний коефіцієнт або респіраторне відношення (ДК або RR), за величиною якого визначається внесок вуглеводів, жирів чи білків у процеси енергоутворення та енергозабезпечення м'язової діяльності. Дихальний коефіцієнт – це відношення об'єму виділеного С02 до об'єму поглинутого О2: (ДК = VC02/V02) за певний період часу. Для вуглеводів він становить 1.

Аеробне окиснення вуглеводів є одним із основних механізмів утворення АТФ у тканинах організму. Воно забезпечує виконання тривалої роботи помірної інтенсивності. Максимально включається у нетренованої людини на 3–4-й хвилині роботи і підтримує її до декількох годин, поки не знизяться запаси глікогену в печінці. Марафонець, наприклад, за рахунок вуглеводів біжить майже 80 хв. Після цього інтенсивно окиснюються жири.
Аеробне окиснення вуглеводів включає такі основні стадії: гліколітичний розпад молекули глюкози до двох молекул піровиноградної кислоти (пірувату), перетворення пірувату на ацетил-КоА та подальше окиснення ацетил-КоА у циклі лимонної кислоти і на дихальному ланцюзі у мітохондріях (рис. 17).
Енергетична ефективність аеробного окиснення молекули глюкози значно більша, ніж анаеробного. При повному окисненні однієї молекули глюкози до С02 та Н20 енергія накопичується у вигля 10 молекул НАДН (дві з них утворюються в гліколізі, дві – під час перетворення пірувату на ацетил-КоА та шість – у циклі лимонної кислоти під час окиснення двох молекул пірувату), а також 2 молекули ФАДН, 2 – ГТФ, що рівноцінні АТФ, і 2 – АТФ у процесі гліколітичного субстратного окиснення. Виходячи з того, що під час передачі двох атомів гідрогену по системі дихальних ферментів в НАДН до кисню утворюється три молекули АТФ, а від ФАДН – дві молекули АТФ, то із 10 НАДН утвориться 30 АТФ, а із 2 ФАДН – 4АТФ. Підсумковий вихід АТФ на одну молекулу глюкози становить (ЗО + 4 + 2 + 2) 38 АТФ.
У печінці, еритроцитах, жировій тканині можливий і інший аеробний шлях прямого окиснення вуглеводів, який називають пентозним циклом. Під час цього циклу накопичується енергія у вигляді НАДФН, яка використовується у біосинтетичних процесах, та утворюються пентози (рибоза та ін.), необхідні для синтезу нуклеотидів (АТФ, НАД, ФАД) і нуклеїнових кислот. Для спортсменів він має дуже важливе значення, особливо під час відновлення організму.
ГЛЮКОНЕОГЕНЕЗ
Процес новоутворення глюкози з невуглеводних речовин називають глюконеогенез. Він відбувається у печінці і нирках, де глюкоза синтезується з амінокислот, особливо аланіну, гліцерину, молочної та піровиноградної кислот, шляхом, зворотним до гліколізу. Цей процес запобігає різкому зниженню рівня глюкози у крові та вичерпанню запасів глікогену в тканинах за умов ненадходження вуглеводів в організм чи виконання тривалої м'язової роботи. При цьому внесок глюконеогенезу для підтримання рівня глюкози крові під час короткочасної роботи незначний (10–20 %), а під час тривалої (протягом кількох годин) зростає до 50 % по відношенню до загальної кількості глюкози, що утворюється в печінці. За такої роботи він відбувається й у скелетних м'язах.
ОБМІН ВУГЛЕВОДІВ ПІД ЧАС ФІЗИЧНИХ НАВАНТАЖЕНЬ
Глікоген м'язів і глюкоза крові є важливим субстратом для утворення АТФ у скелетних м'язах під час виконання фізичної роботи субмаксимальної та великої потужності, наприклад, бігу на 400, 800, 1000 та 10 000 м. Тривалість роботи залежить від запасів глікогену у скелетних м'язах та інтенсивності фізичних навантажень. У разі неінтенсивного навантаження (30 % МСК) запаси глікогену в бічному широкому м'язі стегна знижуються лише на 20–30 % протягом двох годин роботи на велоергометрі, тоді як за умов високої інтенсивності (близько 80 % МСК) запаси глікогену вичерпувались уже після години роботи (Харгривс, 1998).
Глікоген у м'язах найшвидше розпадається в перші ЗО с – 1(5) хв напруженої м'язової роботи. Посилення мобілізації вуглеводів зумовлене підвищенням активності ферментів, що каталізують реакції розпаду. Під час окремих видів м'язової роботи активність глікогенфосфорилази у м'язах нижніх кінцівок збільшується у 2,4 раза. Але ступінь та напрямок змін активності ферментів залежить від тривалості, інтенсивності та типу навантаження. За тривалої роботи швидкість розпаду глікогену у м'язах знижується через зниження активності ферментів. Систематична м'язова діяльність приводить до збільшення концентрації глікогену і підвищення активності ферментів його обміну у м'язах. Це поліпшує їх енергетичний обмін під час фізичних навантажень.
Під час м'язової діяльності зростає мобілізація глюкози з печінки, де вона депонується у вигляді глікогену. Глікоген розпадається до глюкози, яка виходить у кров, що запобігає розвитку гіпоглікемії. Вихід глюкози з печінки в кров посилюється в 2–3 рази у разі м'язової діяльності помірної інтенсивності і в 7–10 разів – за напруженої роботи. Високий рівень глюкози у крові завдяки гомеостатичній функції печінки під час м'язової діяльності підтримується до тих пір, поки не вичерпається запас глікогену. За його рахунок м'язи можуть виконувати роботу великої потужності протягом 20–40 хв, а уже через 1–2 год його запаси суттєво зменшуються. Зі збільшенням тривалості роботи великий внесок у підтримання рівня глюкози крові робить процес глюконеогенезу, що значно активується.
МОЛОЧНА КИСЛОТА ТА ЇЇ ОБМІН У ТКАНИНАХ
Нормою концентрації молочної кислоти у крові вважається 1 – 1,5 ммоль-л-1. Молочна кислота (Нlа) у водному середовищі дисоціює на іон гідрогена (Н+) та аніон кислотного залишку (La-). Аніон кислотного залишку молочної кислоти у водному середовищі здатний взаємодіяти з катіонами металів і утворювати солі – лактати. Тому часто молочну кислоту або її кислотний залишок називають лактатом:
СН3-СНОН-СООН -> сн3-снон-соо- + Н+.
Молочна кислота утворюється у скелетних м'язах з найбільшою швидкістю протягом 40–45 с інтенсивного фізичного навантаження за рахунок максимального включення гліколізу. Рівень молочної кислоти у цьому разі підвищується в 4–5 разів і після напруженої роботи протягом 1–5 хв може досягати 10 ммоль-л-1 у нетренованих людей, а у спортсменів-спринтерів – 20 ммоль-л-1 і більше. Це призводить до закиснення середовища організму (ацидозу). Якщо ємність буферних систем вичерпується, то рН крові може змінюватися від 7,34 до 7,0 або навіть 6,8 за виснажливих навантажень. Розвивається декомпенсаторний ацидоз. Таке закиснення середовища організму впливає на функції нервової системи та скелетних м'язів, викликає біль у м'язах та призводить до зниження працездатності і розвитку стомлення.
Після припинення роботи молочна кислота із м'язів виходить у кров і доставляється у печінку. Близько 55–70 % молочної кислоти окиснюється аеробно і використовується тканинами, в тому числі м'язами, як джерело енергії, близько 5–7 % виводиться з сечею, а 25–30 % її використовується в печінці для новоутворення глюкози і поповнення глікогену та біосинтезу окремих амінокислот під час роботи та одразу після неї. Виведення молочної кислоти з м'язів, її окиснення після припинення роботи прискорюється за умов активного відпочинку.
Оскільки концентрація молочної кислоти в крові залежить від інтенсивності гліколізу в м'язах, а останній – від інтенсивності виконуваних фізичних навантажень і рівня тренованості організму, то за показником приросту молочної кислоти в крові можна оцінити функціональний стан спортсмена. Значне підвищення рівня молочної кислоти в крові після виконання інтенсивного граничного фізичного навантаження, що забезпечується гліколізом, свідчить про високий рівень тренованості, здатність організму працювати в закисненому середовищі та великі можливості гліколітичного механізму енергоутворення. Проте, значне зростання рівня молочної кислоти у крові після виконання стандартного навантаження вказує на низький рівень фізичної підготовки людини.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5635; Нарушение авторских прав?; Мы поможем в написании вашей работы!