
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Загальні властивості ферментів
|
|
|
|
Білкова природа ферментів. Білкова природа ферментів в даний час повністю встановлена. Всі ферменти є простими або складними білками. Наприклад, до простих білків відносяться. ферменти трипсин, уреаза й ін., до складних – каталаза, ферменти, що каталізують окисно-відновні процеси й ін. Усі ферменти добре розчиняються у воді, в розбавлених розчинах кислот, лугів, солей і деяких органічних розчинниках. Водні розчини ферментів проявляють типові ознаки ліофільних колоїдних систем. Для ферментів характерна висока молекулярна маса: від десятка тисяч до декількох мільйонів. Понад 400 ферментів отримано в кристалічному вигляді (рис. 1). Всі вони амфотерні і володіють високою хімічною активністю.
Термолабільність і температурний оптимум дії ферментів. Ферменти – термолабільні сполуки. При дії високих температур вони денатуруються, що призводить спочатку до зменшення, а потім і до припинення каталітичних функцій. Температурний оптимум дії більшості ферментів тварин знаходиться в межах температури тіла – 37 – 40°С. Виключенням є папаїн, найбільша активність каталітичної дії якого виявляється при 80°С, і каталаза, температурний оптимум дії якої лежить між 0 і 10°С. При підвищенні температури середовища на 10°С швидкість реакції зростає в 1,5 – 3 рази (правило ле Шательє) приблизно в межах від 0 до 25°С; потім поволі підвищується і після 40°С починає зменшуватися (рис. 2).

Рис. 1. Кристали фосфоенолпіруваткінази
При температурі 80 – 100°С ферменти втрачають свою каталітичну здатність, оскільки наступає денатурація білкової молекули. Ферменти в розчиненому стані більш чутливі до нагрівання, ніж в сухому. Відомі ферменти, які можуть короткочасно переносити температуру +100°С (аденілаткіназа). З пониженням температури швидкість ферментативних реакцій поступово зменшується, досягаючи мінімуму при 0°С. Деякі ферменти в сухому стані витримують охолоджування до –120–190°С. При поступовому підвищенні температури до +37°С їх активність відновлюється. Ця властивість використовується при зберіганні сперми для штучного запліднення тварин.
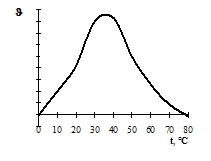
Рис. 2. Залежність швидкості ферментативної реакції від температури
Вплив реакції середовища на активність ферментів. Кожний фермент проявляє максимальну для нього каталітичну дію при певному значенні рН, яке називається рН-оптимумом. Так, для пепсину рН-оптимум рівний 1,5 – 2,5, катепсина – 4,5 – 5,0, карбоксилази – 4,8, уреази – 7,2 – 8,0, трипсину – 7,5 – 9,5 і т.д (табл 1).
Більшість ферментів проявляє максимальну каталітичну активність при рН = 7 (рис. 3). Зміни рН уповільнюють або припиняють дію ферментів.
Вплив рН на активність ферментів пояснюється структурою їх молекул. Молекула ферменту має один або декілька активних центрів, в яких сконцентровані функціональні групи білків (рис. 5).
Таблиця 1.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 566; Нарушение авторских прав?; Мы поможем в написании вашей работы!