
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізомерази
|
|
|
|
Ліази
Ліази – це ферменти, що каталізують реакції негідролітичного відщеплення певних груп від субстратів з утворенням подвійних зв’язків або реакції приєднання цих груп по подвійних зв’язках. Деякі ліази, на відміну від лігаз, здійснюють реакції синтезу окремих речовин без участі макроергічних сполук. Більшість ліаз – складні білки, що містять в молекулах фосфорні ефіри водорозчинних вітамінів. Клас складається з шести підкласів: вуглець-вуглець-ліази, вуглець-кисень-ліази, вуглець-азот-ліази, вуглець-сірка-ліази і вуглець-галоїд-ліази та ін.
4.1. Вуглець-вуглець-ліази. Ферменти, які здійснюють в основному розрив С–С-зв’язків. В підклас входять три підпідкласи: карбокси-ліази, альдегід-ліази і ліази кетокислот. Типовим представником є піруватдекарбоксилаза (карбокси-ліаза 2-оксокислот, КФ 4.1.1.1), яка здійснює декарбоксилування:
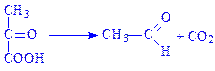
4.2. Вуглець-кисень-ліази. Їх часто називають гідроліазами, або дегідратазами (гідратазами). Самим вивченим ферментом підкласу є карбонат-дегідратаза, або карбоангідраза (карбонат – гідро-ліаза, КФ 4.2.1.1), що каталізує реакцію:
H2CO3 = CO2 + H2O
4.3. Вуглець-азот-ліази. Це ферменти, які здійснюють відщеплення від певних субстратів аміаку або амідинових груп. Наприклад, аспартат – аміак-ліаза (L-аспартат –аміак-ліаза, КФ 4.3.1.1) дезамінує аспартат:
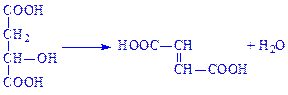
Фермент аргініносукцинат-ліаза (L-аргініносукцинат – аргінін-ліаза, КФ 4.3.2.1) розкладає аргінінянтарну кислоту:
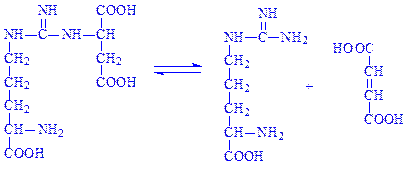
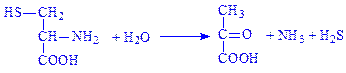
4.4. Вуглець-сірка-ліази. Це ферменти, за допомогою яких розщеплюється зв’язок між вуглецем і сіркою. Прикладом є цистеїндесульфгідраза (L-цистеїн:сірководень-ліаза (дезамінуюча), КФ 4.4.1.1), що каталізує реакцію:
До інших підкласів ліаз належать також вуглець-галоїд-ліази (4.5) і фосфор-кисень-ліази (4.6). Із інших ліаз (4.99) відомий такий фермент, як феррохелатаза (4.99.1.1), що каталізує включення заліза в молекулу гема.
Ці ферменти каталізують реакції внутрішньомолекулярного переміщення різних груп органічних речовин. Складаються з п’яти підкласів.
5.1. Рацемази і епімерази. Каталізують реакції інверсії асиметричних груп в молекулах різних речовин. Розрізняють чотири підпідкласи: рацемази і епімерази амінокислот і їх похідних, оксикислот і їх похідних, вуглеводів і їх похідних і інших сполук. Ферменти, що здійснюють реакції ізомеризації в субстратах з одним асиметричним атомом, називають рацемазами. До них слід віднести бактерійні ферменти, які перетворюють L-амінокислоти в D-амінокислоти, зокрема аланінрацемазу (аланінрацемаза, КФ 5.1.1.1):
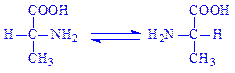
Ферменти, що здійснюють перетворення субстратів з декількома асиметричними атомами вуглецю, називаються епімеразами. Так, УДФ-глюкозоепімераза (УДФ-глюкозо – 4-епімераза, КФ 5.1.3.2) в тканинах молочної залози ізомеризує УДФ-глюкозу в УДФ-галактозу, яка необхідна для біосинтезу лактози (за участі НАД і іонів Mg2+):
УДФ-глюкоза «УДФ-Галактоза
5.2. Цис-транс-ізомерази. Ці ферменти змінюють геометричну конфігурацію органічних сполук, що містять подвійні зв’язки. Зокрема, малеїнатізомераза (малеїнат – цис-транс -ізомераза, КФ 5.2.1.1) здійснює перетворення:

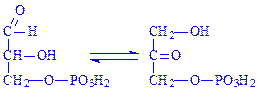
5.3. Внутрішньомолекулярні оксидоредуктази. Ці ферменти каталізують взаємні перетворення альдоз і кетоз. З їх участю окислюються –CH–ОН-групи, одночасно відновлюється сусідня СО-група. Так, тріозофосфатізомераза (D-гліцеральдегід-3-фосфат – кетол-ізомераза, КФ 5.3.1.1) каталізує реакцію:
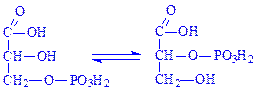
5.4. Внутрішньомолекулярні трансферази. Ці ферменти часто називають мутазами. Вони переносять певні групи з однієї частини молекули на іншу. Так, під впливом фосфогліцерат-фосфомутази (D-фосфогліцерат – 2,3-фосфомутази, КФ 5.4.2.1) відбувається реакція:
5.5. Внутрішньомолекулярні ліази. До ферментів, що каталізують внутрішньомолекулярні перетворення ліазного типу, відноситься муконат-циклоізомераза (4-карбоксиметил-4-оксиізокротонолактон – ліаза (дециклізуюча), КФ 5.5.1.1), що каталізує реакцію:
(+)-4-карбоксиметил-4-окси-ізокротонолактон = Цис-цис -муконат
6. лігази (синтетази)
Ці ферменти каталізують реакції з’єднання двох молекул та реакції спряжені з відщепленням залишків фосфорної кислоти від АТФ або її аналогів. Термін „лігази” застосовують також до ферментів, що каталізують реакції синтезу без нуклеозидтрифосфатів. Вони сприяють утворенню хімічних зв’язків, що власне і є причиною їх назви (від лат. ligare – зв’язувати). Механізм реакцій складний. Він є або трьохстадійним перенесенням, або утворенням потрійних комплексів. Кофакторами багатьох лігаз є біотин і його похідні. Число лігаз, відомих зараз, досягає 100.
6.1. Лігази, які утворюють С–О-зв’язки. До підкласу належать ферменти, що каталізують приєднання амінокислот до відповідних тРНК. Число лігаз відповідає кількості амінокислот, які використовуються для біосинтезу молекул білків. Утворюються аміноацил-тРНК. Так, тирозил-тРНК – синтетаза (L-тирозин: тРНК – лігаза (АМФ), КФ 6.1.1.1) за наявності іонів Mg2+ і K+ каталізує реакцію
АТФ + L-Тирозин + тРНК = АМФ + Пірофосфат + L-Тирозил-тРНК
6.2. Лігази, які утворюють С–S-зв’язки. Ці ферменти здійснюють утворення С–S-зв’язків між залишками жирних кислот і KoA. Зв’язок макроергічний. Активований залишок жирної кислоти залучається до всіляких реакцій синтезу або розщеплення. Так, під впливом ацетил-KoA – синтетази (ацетат: KoA – лігази (АМФ), КФ 6.2.1.1) і за наявності іонів Mg2+ в різних тканинах протікає реакція
АТФ + Ацетат + KoA = АМФ + Пірофосфат + Ацетил-КоА
6.3. Лігази, які утворюють С–N-зв’язки. Підклас складається з п’яти підпідкласів: амідсинтетази, пептидсинтетази, циклолігази, інші С–N-лігази і С–N-лігази з глутаміном в ролі N-донора. Особливе значення мають пептидсинтетази, під впливом яких з амінокислот синтезуються пептиди. Наприклад, g-глутамілцистеїнсинтетаза (L-глутамат:L-цистеїн – лігаза (АДФ), КФ 6.3.2.2) в тканинах печінки за наявності іонів Mg2+ каталізує реакцію утворення дипептида:
АТФ + L-Глутамат + L-Цистеїн = АДФ + Ортофосфат + g-L-глутаміл-L-цистеїн
6.4. Лігази, які утворюють С–С-зв’язки. З цього підкласу найбільш детально вивчена карбоксилаза, що каталізує реакцію карбоксилування. Так, під впливом піруваткарбоксилази (піруват: CO2 – лігази (АДФ), КФ 6.4.1.1) в тканинах за наявності іонів Mg2+ з піровиноградної кислоти і вуглекислого газу утворюється щавелевооцтова кислота:
АТФ + СН3–СО–СООН + СО2 + Н2О = НООС–СН2–СО–СООН + АДФ + Н3РО4
Другий фермент цього підпідкласу ацетил-КоА – карбоксилаза (ацетил-КоА:CO2 – лігаза (АДФ), КФ 6.4.1.2) каталізує утворення з ацетил-КоА і СО2 малоніл-КоА – проміжного продукту біосинтезу вищих жирних кислот:
АТФ + Ацетил-КоА +СО2 + Н2О = АДФ + Ортофосфат + Малоніл-КоА
Класифікація і номенклатура ферментів у ході розвитку біохімії і в результаті відкриття нових ферментів постійно удосконалюються, а їх число з кожним роком збільшується.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 2035; Нарушение авторских прав?; Мы поможем в написании вашей работы!