
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гідроліз солей
|
|
|
|
Буферні розчини.
Теорія електролітичної дисоціації.
Розчини електролітів.
План лекції
Електроліти - це складні речовини, які в розчиненому чи в розплавленому стані проводять електричний струм.
Під дією полярних молекул розчинника (в розчинах) або температури (в розплавах) електроліти розпадаються на позитивно і негативно заряджені частинки - йони. Цей процес називається електролітичною дисоціацією. Частинки рухаються при цьому хаотично. Їх рух в електричному полі пояснює здатність електролітів проводити електричний струм. Позитивно заряджені частинки рухаються до негативного електрода - катода і називаються катіонами, а негативно заряджені частинки рухаються до позитивного електрода - анода і називаються аніонами. За своїми властивостями йони суттєво відрізняються від нейтральних атомів та молекул, з яких утворилися.
Теорія електролітичної дисоціації (Арреніус 1887 р.)
1. Розчинення електроліту супроводжується розпадом його молекул на йони.
2. Дисоціація, як правило, відбувається неповністю, тобтоє оборотнім процесом.
3. Електропровідність розчинів електролітів пропорційна загальній концентрації йонів у розчині.
Згадаємо, що таке кислоти, основи та солі з точки зору електролітичної дисоціації. Навести приклади.
Кислоти – це електроліти, які дисоціюють у водному розчині з утворенням іонів Гідрогену. Наприклад, HNO3 → H+ + NO3-
Основи – це електроліти, які дисоціюють у водному розчині з утворенням гідроксид-іонів. Наприклад, NaOH → Na+ + OH-
Солі – це сильні електроліти, які дисоціюють у водному розчині з утворенням катіонів металу та аніонів кислотного залишку. Наприклад, K2SO4 → 2K+ + SO42-.
Для кількісної характеристики процесу дисоціації було введено поняття ступінь дисоціації а - відношення числа молекул, що розпалися на йони до вихідного числа розчинених молекул: α = Nдис./ Nзаг. Ступінь дисоціації – є мірою спроможності речовини розпадатися на йони.
Вимірюють α у частках одиниці або у відсотках. Він змінюється в межах від нуля (неелектроліт) до 1 або 100% (повна дисоціація).
Електроліти, в яких α>30%, вважаються сильними, це практично всі розчинні у воді солі, гідроксиди лужних та лужноземельних металів (NaOH, KOH, Ca(OH)2, Ba(OH)2), деякі кислоти (НС1, H2SO4, HNO3, HClO4).
Для слабких електролітів α<3%. Це більшість кислот (H2S, HCN, H2CO3, CH3COOH, H2C2O4), вода, основи (NH4OH, Cu(OH)2, Fe(OH)2), амфотерні гідроксиди (Al(OH)3, Zn(OH)2). В розчинах слабких електролітів процес дисоціації (іонізації) супроводжується зворотною реакцією асоціації йонів. Обидва процеси протікають одночасно, внаслідок чого в розчині встановлюється динамічна рівновага. Чим слабкіший електроліт, тим рівновага більше зміщена в бік асоціації йонів.
Іноді окремо виділяють групу електролітів середньої сили, для яких 3%<α<30% ( H3PO4, H2SO3, Mg(OH)2 ).
Ступінь дисоціації залежить від:
1) природи розчинника та розчиненої речовини;
2) концентрації розчину;
3) температури;
4) присутності однойменного йону.
Для сильних електролітів дисоціація відбувається практично повністю:
K2SO4 → 2K+ + SO42-
Для слабких – дисоціація є оборотнім процесом:
H2SO3 ↔ 2H+ + SO32-
І стадія: H2SO3 ↔ H+ + HSO3-
ІІ стадія: HSO3- ↔ H+ + SO32-
Для розчинів слабких електролітів можна записати вираз константи дисоціації: 
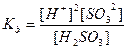 .
.
Якщо відоме значення α, тоді 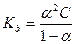 , де С – загальна концентрація електроліту.
, де С – загальна концентрація електроліту.
Чиста вода за звичайних умов незначною мірою проводить електричний струм. Це пояснюється тим, що приблизно лише одна з 10 млн. молекул води дисоціює на йони. Процес дисоціації води називають автоіонізацією:
1) H2O ↔ H+ + OH-; 2) H+ + H2O ↔ Н3О+; 2H2O ↔ ОН- + Н3О+ (іон оксонію)
Кдис.=[H+][OH-]/[H2O].
Вода (Н2О) - слабкий електроліт, тому с(Н2О) = [Н2О] = 55,5 моль/дм3. Таким чином, кількість речовини Н2О 55,5 моль/дм3 можна вважати сталою величиною. Величина [H+][OH-] = 10-14 і називається йонний добуток води.
У чистій воді: [H+] = [OH-] = 10-7.
На практиці користуватися значеннями рівноважних концентрацій іонів Гідрогену та гідроксид –іонів досить незручно, тому було введено величину рН та рОН.
pH = -lg[H+]- водневий показник, pОH = -lg[ОH-] - гідроксидний показник.
pОH = 14 - рН
Для характеристики кислотності середовища зручно користуватися водневим показником рН
У чистій воді та в нейтральному середовищі [H+] = [OH-] = 10-7.
рН = pOH = 7.
У кислому середовищі [H+] > 10-7, звідсизначення рН < 7, а рОН > 7.
У лужному середовищі [H+] < 10-7 значення рН > 7, а рОН < 7.
Приклад. Обчислити рН у 0,01М розчині нітратної кислоти.
Дано: Розв’язок:
С(HNO3) = 0,01 моль/л. Пишемо рівняння дисоціації даної кислоти та
Визначити рН. визначаємо молярну концентрацію іонів Н+:
HNO3 → H+ + NO3-,
За рівнянням реакції: 1 моль 1 моль 1 моль
За умов задачі: См: 0,01 0,01 0,01,
тобто [Н+] = С(HNO3) = 0,01 моль/л
рН = -lg[H+] = -lg0,01 = 2.
Відповідь: рН = 2.
Хімічні реакції часто проходять з виділенням чи зв'язуванням іонів Н+. А для проходження реакції необхідна стала концентрація цих іонів або стала величина рН.
Для створення і підтримання сталого рН реакційного середовища протягом перебігу реакції в хімічних і біологічних системах використовують буферні розчини. Буферний розчин перешкоджає зміні рН, яка може бути при розведенні розчину або при додаванні до нього сильної кислоти чи сильної основи.
Буферні розчини - це суміш слабкої кислоти і солі цієї кислоти, або суміш слабкої основи і солі цієї основи, або суміш розчинів солей багатоосновних кислот різного ступеня заміщення. Тобто буферні розчини є спряженими системами. Таким чином, буферна система - це суміш спряженої кислоти і основи.
Наприклад: а) ацетатна буферна суміш (СН3СООН + СН3СООNa);
б) амоніачна буферна суміш (NН3∙Н2О + NH4С1);
Складові частини буферної суміші можуть взаємодіяти з іонами кислоти (H+) чи гідроксид-іонами лугу (OH-), внаслідок чого рН розчинів зберігається сталим при додаванні до них невеликої кількості речовини сильної кислоти чи сильної основи. Діябуферної системи ґрунтується на дії спільного йона.
Наприклад, є ацетатна буферна суміш:
СН3СООН ↔ H+ + СН3СОO-
СН3СОONа = Nа+ + СН3СОO-
При додаванні до цієї системи сильної кислоти, наприклад, нітратної НNО3 ацетат-іони будуть зв'язувати іони від сильної кислоти у слабкий електроліт - ацетатну кислоту:
НNO3 à Н+ + NO3-
Н+ + СН3СОО- ↔ СН3СООН
і рівновага реакції майже не порушиться, тобто значення рН у розчині залишиться практично сталим.
рНбуф.р-ну= рКкислоти + lg (Ссолі/Скислоти)
Гідроліз - це взаємодія солей з водою.
В основі всіх варіантів гідролізу лежать процеси часткового зв'язування йонів Н+ або ОН- з йонами розчиненої солі з утворенням слабких електролітів.
Розглянемо рівновагу в розчині солі сильної основи і слабкої кислоти, наприклад, ацетату натрію. Розчиняючись у воді, ця сіль повністю дисоціює на йони:
СН3СООNа ® Nа+ + СН3СОО-.
Ацетат-йон оборотне зв'язує йон Н+ води, йони Nа+ з йонами ОН- води у розчині не зв'язуються, оскільки NаОН - сильна основа, яка в розчині повністю розпадається на йони:
Nа+ + СН3СОO‑ + НОН ↔ СН3СООН + Nа+ + ОН.
Оскільки йони Nа+ не беруть участі в реакції, їх можна виключити з йонного рівняння гідролізу:
СН3СОО- + НОН ↔ СН3СООН + ОН-.
СН3СООNа+Н2О ® СН3СООН + NаОН.
Йонне рівняння краще відображає суть і причину процесу гідролізу - часткового зв'язування залишку слабкої кислоти з йонами Н+ води і те, що розчин матиме лужну реакцію (зростання концентрації йонів ОH-, тобто рН>7). Реакція гідролізу оборотна, оскільки слабкі електроліти Н2О і СН3СООН знаходяться по різні боки від знака рівності і в розчині встановлюється динамічна рівновага.
У розчині солі слабкої основи і сильної кислоти відбувається оборотне ступінчасте часткове зв'язування йонів ОH- води з катіоном, який утворює слабку основу.
Сu(NO3)2® Cu2+ + NO3-
Cu2+ + HOH ↔ Cu(OH)2 + H+
Сu(NO3)2 + H2O ↔ HNO3 + Cu(OH)2
Реакція розчину є кислою (рН < 7), оскільки утворюється надлишок йонів H+. Як і в попередньому прикладі, перший ступінь гідролізу відбувається інтенсивніше, ніж наступні.
У розчині солі слабкої основи і слабкої кислоти йон Н+ води зв'язується з залишком слабкої кислоти, а йон ОН- - із залишком слабкої основи. Як приклад, запишемо рівняння гідролізу солі СН3СООNН4 в йонній і молекулярній формах:
СН3СОO- + NH4++ НОН ↔ СН3СООН + NH4ОН
СН3СООNH4 + Н2О ↔ СН3СООН + NH4ОН.
Деякі солі слабкої кислоти і слабкої основи зазнають повного (необоротного і неступінчастого) гідролізу.
У розчині солі сильної кислоти і сильної основи процес гідролізу не відбувається.
Ступінь гідролізу характеризує стан рівноваги реакції гідролізу.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1129; Нарушение авторских прав?; Мы поможем в написании вашей работы!