
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Номенклатура та ізомерія спиртів
|
|
|
|
Лекція 17. Насичені одноатомні та багатоатомні спирти. Гліколі. Гліцерин.
Застосування гомологів бензолу.
Гомологи бензолу використовують у промисловому органічному синтезі. Толуол, наприклад застосовують для синтезу бензойної кислоти. З пара -ксилолу добувають терефталеву кислоту, яка використовується у виробництві хімічних волокон.
Багато гомологів бензолу застосовують як розчинники органічних речовин та полімерів.
Література
Основна література.
65. Глінка М.Г., Загальна хімія. – К.: Вища школа, 1982. – 607 с.
66. Рейтер Л.Т., Степаненко О.М., Басов В.П., Теоретичні розділи загальної хімії. Київ.: „Каравела”, 2003. – 342 с.
67. Сегеда А.С. Аналітична хімія. Якісний і кількісний аналіз. К.: ЦУЛ, 2003. –311с.
68. Логинов Н.Я. Аналитическая химия. /Логинов Н.Я., Воскресенський А.Г., Солодкин, И.С./ – М.: “Просвещение”, 1975. – 477с.
Додаткова література.
69. Басов В.П., Родіонов В. М. „Хімія”. Київ.: „Каравела”, 2004. – 318 с.
70. Омелян В.І, Шешеня С.К. Навчальний комплекс з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. загальні основи аналітичної хімії. Для віртуально-тренінгової технології самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”, 7.00503.02 “Товарознавство та експертиза в митній справі”. – Полтава: РВВ ПУСКУ, 2002. – 179.
71. Омелян В.І. Опорний конспект лекцій з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. Загальні основи аналітичної хімії для студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі” та МІПК. – Полтава: РВВ ПУСКУ, 2003. – 60.
72. Омелян В.І., Зайцева І.В. Хімія і методи дослідження сировини та матеріалів: Методичні рекомендації. Частина 1. Методичні рекомендації до самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі”. –Полтава: РВВ ПУСКУ, 2004. – 23 с.
План
1. Номенклатура та ізомерія спиртів.
2. Властивості спиртів.
3. Добування та застосування.
Спирти — органічні речовини, молекули яких містять гідроксильні групи —ОН, сполучені з вуглеводневими радикалами. Загальна назва спиртів — гідроксильні сполуки.
Залежно від числа гідроксильних груп, що містяться в молекулі, розрізняють одноатомні, двохатомні, трьохатомні спирти:
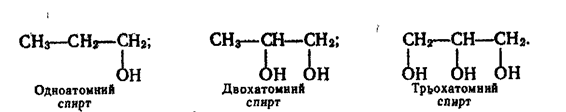
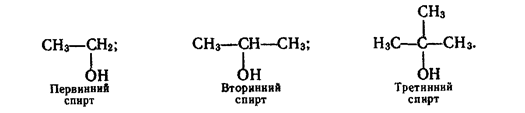
Спирти поділяють також на первинні, в яких гідроксильна група сполучена з первинним вуглецевим атомом, вторинні — група —ОН приєднана до вторинного атома вуглецю і третинні — група —ОН знаходиться біля третинного вуглецю. Приклади таких спиртів:
Номенклатура та ізомерія гідроксильних сполук
Номенклатура. За міжнародною номенклатурою назви спиртів утворюють від назв відповідних алканів з додаванням закінчення -ол. Після закінчення зазначають номер вуглецевого атома, біля якого знаходиться гідроксильна група. Нумерацію вуглецевих атомів починають з того кінця ланцюга, до якого ближче розташована гідроксильна група. У назви двохатомних та інших багатоатомних спиртів перед закінченням -ол. додають префікс ди- (ді-), три- і т. д. залежно від кількості груп, а потім зазначають положення всіх груп. Приклади:
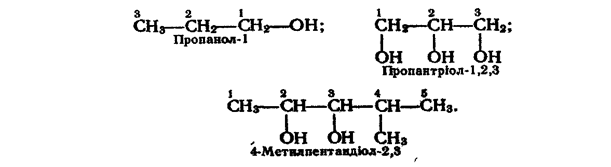
Для деяких спиртів поширені назви за раціональною номенклатурою. Ці назви утворюють з назви радикала і слова «спирт», наприклад: СН3ОН — метиловий спирт, С2Н5ОН - етиловий спирт, (СН3)2СНОН - ізопропіловий спирт.
Ізомерія. Ізомерія спиртів пов'язана як з розгалуженням вуглецевого ланцюга, так і з різним положенням гідроксильної групи. Наприклад, бутанол С4Н9ОН може мати такі ізомери:
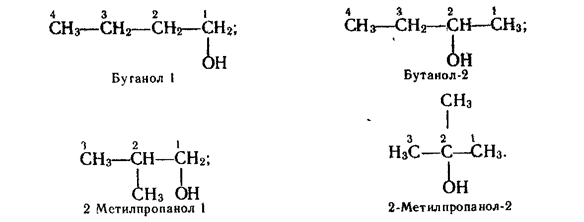
Наведені ізомери різняться властивостями, наприклад температурами кипіння, які дорівнюють 117,3°С (бута-нол-1); 99,5°С (бутанол-2); 108,4°С (2-метилпропа-нол-1); 82,5°С (2-метилпропанол-2).
Насичені одноатомні спирти
До насичених одноатомних спиртів належать аліфатичні спирти, молекули яких містять одну гідроксильну групу, сполучену з алкільним радикалом.
Гомологічний ряд. Члени гомологічного ряду насичених одноатомних спиртів мають загальну формулу СnН2n+1ОН, де n = 1, 2, 3, 4. Першими членами цього ряду є СН3ОН — метанол, С2Н5ОH — етанол, С3Н7ОН — пропанол, С4Н9ОН — бутанол.
Властивості. За звичайних умов насичені одноатомні спирти з нормальною будовою ланцюга, що містять від 1 до 11 атомів вуглецю,— це безбарвні рідини. Зі збільшенням молекулярної маси спиртів їх розчинність у воді зменшується: метанол, етанол і пропанол змішуються з водою в будь-яких співвідношеннях, бутаном та інші рідкі за звичайних умов спирти розчиняються у воді мало, а вищі спирти практично не розчиняються у воді.
Спирти мають досить високі температури кипіння. Це пов'язано з асоціацією їх молекул, яка відбувається так само, як і асоціація молекул води, за рахунок утворення водневих зв'язків між молекулами RОН (R — вуглеводневий радикал):
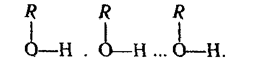
Хімічні властивості спиртів обумовлені переважно наявністю гідроксильної групи в молекулі.
1. Взаємодія з лужними металами. Під дією лужних металів на спирти утворюються алкоголяти:

Ця реакція відбувається з розривом зв'язку О—Н у гідроксильній групі.
2. Взаємодія з галогеноводнями та іншими галогеновмісними речовинами. Під дією ґалогеноводнів або хлоридів фосфору РСl5, РСІ3 на насичені одноатомні спирти відбувається заміщення групи ОН у спиртах на галоген, наприклад:
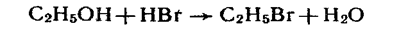
Ця реакція за участю гідроксильної групи відбувається з розривом зв'язку С—О.
3. Дегідратація. При наявності фосфорної або концентрованої сірчаної кислоти при нагріванні від спиртів відщеплюється вода і утворюються ненасичені вуглеводні, наприклад:

4. Взаємодія з кисневмісними кислотами. Спирти реагують з кислотами, утворюючи складні ефіри. Наприклад, під час взаємодії метанолу з азотною кислотою утворюється складний ефір азотної кислоти — метилнітрат:
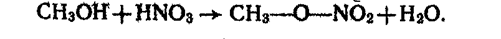
Складні ефіри утворюються також при взаємодії спиртів з органічними кислотами.
5. Окислення. Під час спалювання спиртів (окислення киснем повітря) утворюються оксид вуглецю (IV) і вода:
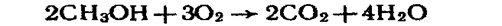
При каталітичному окисленні киснем повітря, окисленні перманганатом калію, дихроматом калію при наявності сірчаної кислоти утворюються альдегіди і кетони, наприклад:
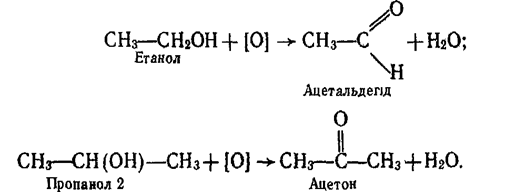
Третинні спирти більш стійкі до окислення. Тільки під дією сильних окислювачів вони можуть окислюватися з розщепленням вуглецевого ланцюга.
6. Дегідрування. Під час каталітичного дегідрування первинних спиртів утворюються альдегіди, вторинних спиртів — кетони:
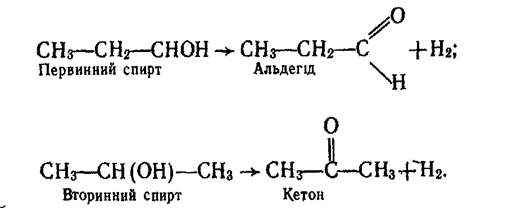
Каталізатором дегідрування спиртів звичайно є мідь (температура 300°С).
Добування. Насичені спирти можна добути гідролізом галагенопохідних відповідних алканів водним розчином лугу, наприклад:
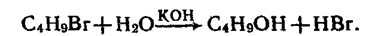
Бромбутан Бутанол
Спирти утворюються також при гідратації алкенів:

Спирти можна добути відновленням інших кисневмісних сполук — альдегідів і кетонів.
Інші методи добування спиртів розглянуто при вивченні окремих представників гомологічного ряду.
Метанол. Метанол, або метиловий спирт, СН3ОН — безбарвна рідина з характерним запахом спиртів. Дуже отруйний.
Найважливіший промисловий метод добування метанолу ґрунтується на використанні синтез-газу (суміш СО з Н2), який добувають конверсією метану з водяною парою. Для добування метанолу синтез-газ пропускають над каталізатором (сумішшю оксидів міді, цинку і алюмінію) при температурі 200-300°С і тиску 6—8 МПа:
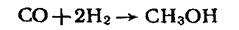
Старий метод промислового добування метанолу полягає в сухій перегонці деревини, внаслідок чого спирт дістав назву деревного.
Метанол — важливий продукт хімічної промисловості. У великих кількостях його переробляють на формальдегід. З нього добувають і інші органічні речовини, наприклад ефіри кислот. Метанол використовують у промисловому органічному синтезі як метилуючий агент (для введення могильної групи в різні сполуки).
Метанол застосовують як розчинник у лакофарбовій промисловості, як компонент пального для автомобілів (добавка метанолу до бензину підвищує октанове число пального).
Етанол. Етанол, або етиловий спирт, С2Н5ОН — безбарвна рідина з характерним запахом. Тривіальна назва етанолу — винний спирт.
Основним промисловим методом добування етанолу є каталітична гідратація етилену. Реакція відбувається над каталізатором на основі фосфорної кислоти при температурі 260—300°С і тиску 7—8 МПа:

Етанол утворюється під час бродіння продуктів, що містять крохмаль і цукристі речовини (зерна, фруктів, овочів). Бродіння—складний процес. Сумарну реакцію, яка відбувається під час бродіння поширеної цукристої речовини — глюкози С6Н12O6, можна виразити рівнянням:
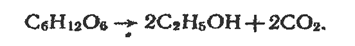
Недоліком цього методу добування спирту є використання харчової сировини.
Як сировину для добування етанолу можна використати деревину, що містить целюлозу. Під час гідролізу целюлози утворюється глюкоза, зброджуванням якої добувають етанол.
Етанол є одним з великотоннажних продуктів промислового органічного синтезу. Він застосовується у виробництві оцтової кислоти, бутадієну-1,3, ефірів. Як розчинник етанол застосовують у лакофарбовій промисловості. У великих кількостях його використовують у виробництві ліків і в харчовій промисловості. З технічною метою часто застосовують денатурований спирт — етанол з домішкою речовин, шкідливих для організму.
Насичені багатоатомні спирти
Багатоатомні спирти містять у молекулі кілька гідроксильних груп.
Двохатомні спирти називають д і о л а м и, або гліколями. Назви двохатомних спиртів за міжнародною номенклатурою складають з назви відповідного алкану з додаванням закінчення -діол і цифр, які означають положення гідроксильної групи в ланцюгу.
Трьохатомні спирти називають тріодами, або гліцеринами. їх назви будують аналогічно до назв двохатомних спиртів, але з додаванням закінчення -тріол.
Найпростіші представники двох- і трьохатомних спиртів:

Властивості. Хімічні властивості багатоатомних спиртів багато в чому подібні до властивостей одноатомних спиртів. При цьому в реакціях може брати участь як одна, так і дві і більше гідроксильних груп. Нижче розглядаються властивості багатоатомних спиртів на прикладі етиленгліколю і гліцерину. Це безбарвні в'язкі сиропоподібні рідини, солодкуваті на смак, добре розчиняються у воді.
1. Взаємодія з лужними металами. Лужні метали витісняють водень з гідроксильних груп з утворенням гліколятів або гліцератів:
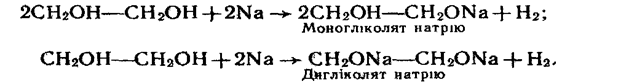
Аналогічно реагує з лужними металами гліцерин, при цьому можуть утворюватись моно-, ди- і тригліцераги.
2. Взаємодія з галогеноводнями. Багатоатомні спирти реагують з галогеноводнями (НС1, НВг, НІ) з утворенням гадогенозаміщених спиртів або галагенопохідних алканів:

3. Взаємодія з кислотами. З кислотами багатоатомні спирти утворюють складні ефіри, наприклад:

Складні ефіри гліцерину з органічними кислотами називають жирами.
4. Взаємодія з гідроксидом міді (II). Ця реакція характерна тільки для багатоатомних спиртів. Осад гідроксиду міді (II) розчиняється в етиленгліколі та гліцерині з утворенням розчину яскраво-синього кольору:
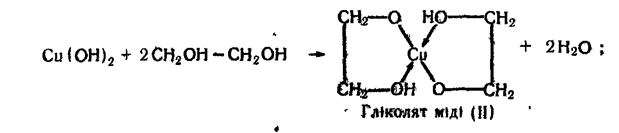
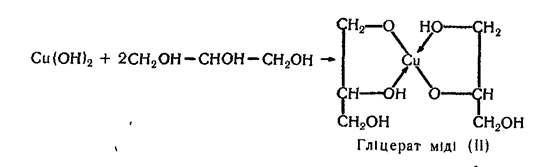
У записаних формулах гліколяту і гліцерату міді (II) стрілками показані донорно-акцепторні зв'язки (мідь — акцептор). Сполуки такого типу належать до комплексних.
Добування і застосування етиленгліколю і гліцерину. Етиленгліколь добувають у промисловості гідратацією (приєднання води) етиленоксиду:
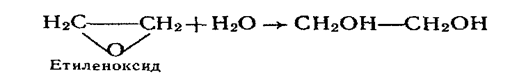
Як і одноатомні спирти, етиленгліколь можна добути гідролізом галагенопохідних алканів водним розчином лугів. Для цієї реакції необхідні 1,2-дигалогенопохідні етану:

Етиленгліколь утворюється під час пропускання етилену крізь розчин перманганату калію, при цьому відбуваються окислення і гідратація етилену:
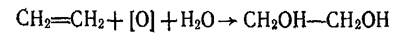
Гліцерин добувають синтетичне з пропілену за такою схемою:
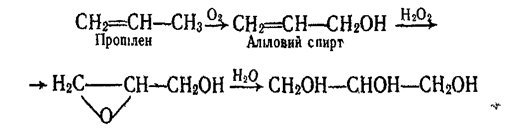
Гліцерин входить до складу природних сполук — жирів рослинного і тваринного походження — і може бути виділений з них.
Етиленгліколь і гліцерин використовуються в промисловому органічному, синтезі.
Гліцерин застосовують для виробництва мастил, як пом'якшувач шкіри і тканин, у парфумерній, фармацевтичній і харчовій промисловості.
Водні розчини етиленгліколю і гліцерину замерзають при низьких температурах, тому їх використовують як антифризи — рідини з низькою температурою замерзання, які застосовуються для охолодження двигунів внутрішнього згоряння.
Гліцерин.
Єдиний практично важливий представник трьохатомного спирту. Сіропоподібна солодка рідина, без кольору, добре розчинна у воді. Водні розчини гліцерину замерзають при низькій температурі.
Гліцерин широко розташований у природі, є основним спиртом, приймає участь у будові молекул різних груп ліпідів. У промисловості гліцерин добувають гідролізом ацилгліцеринів:
О
½½
 СН2-О-С-R
СН2-О-С-R
О СН2ОН
½½ ½
 СН-О-С-R1 + 3Н2О ® СН-ОН + R-СООН + R1-СООН + R2-СООН
СН-О-С-R1 + 3Н2О ® СН-ОН + R-СООН + R1-СООН + R2-СООН
О ½ карбонові кислоти
½½ СН2ОН
СН2-О-С-R2 гліцерин
тригліцерин
Гліцерин широко використовується в багатьох галузях промисловості. Основна його кількість витрачається для добування похідних - гліфталевих смол, нітрогліцерину.
У харчовій промисловості гліцерин використовують для приготування лікерів та безалкогольних напоїв, у паперовій та шкіровеній - для збереження матеріалів від висихання. Він входить у склад багатьох косметичних препаратів і широко використовується як пом'ягчуюча шкіру речовина.
Література
Основна література.
73. Глінка М.Г., Загальна хімія. – К.: Вища школа, 1982. – 607 с.
74. Рейтер Л.Т., Степаненко О.М., Басов В.П., Теоретичні розділи загальної хімії. Київ.: „Каравела”, 2003. – 342 с.
75. Сегеда А.С. Аналітична хімія. Якісний і кількісний аналіз. К.: ЦУЛ, 2003. –311с.
76. Логинов Н.Я. Аналитическая химия. /Логинов Н.Я., Воскресенський А.Г., Солодкин, И.С./ – М.: “Просвещение”, 1975. – 477с.
Додаткова література.
77. Басов В.П., Родіонов В. М. „Хімія”. Київ.: „Каравела”, 2004. – 318 с.
78. Омелян В.І, Шешеня С.К. Навчальний комплекс з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. загальні основи аналітичної хімії. Для віртуально-тренінгової технології самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”, 7.00503.02 “Товарознавство та експертиза в митній справі”. – Полтава: РВВ ПУСКУ, 2002. – 179.
79. Омелян В.І. Опорний конспект лекцій з дисципліни хімія і методи дослідження сировини та матеріалів. Частина I. Загальні основи аналітичної хімії для студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі” та МІПК. – Полтава: РВВ ПУСКУ, 2003. – 60.
80. Омелян В.І., Зайцева І.В. Хімія і методи дослідження сировини та матеріалів: Методичні рекомендації. Частина 1. Методичні рекомендації до самостійної роботи студентів спеціальностей: 7.0503.01 “Товарознавство та комерційна діяльність”,7.0503.02 “Товарознавство та експертиза в митній справі”. –Полтава: РВВ ПУСКУ, 2004. – 23 с.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 13820; Нарушение авторских прав?; Мы поможем в написании вашей работы!