
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гибридизация электронов углерода. s- и p- связи
|
|
|
|
При изучении природы ковалентных связей атомов углерода пришлось сделать допущение, что валентные электроны в процессе образования химических связей располагаются не на чистых s- и р-орбиталях, а на смешанных (гибридных) орбиталях. Это явление получило название гибридизации. При образовании молекулы метана
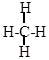
углерод тратит на образование связей один s-электрон и три р-электрона. Одна из этих связей должна быть менее прочной, т.к. перекрывание s-орбиталей углерода с s-орбиталью водорода будет меньшим, чем перекрывание р-орбитали углерода с s-орбиталью водорода. В действительности, данная структурная формула показывает, что все четыре связи Н-С в молекуле метана равноценны, т.е. четыре электрона углерода при образовании химических связей распределяются на 4-х одинаковых "гибридных" орбитах (явление sр3-гибридизации). Путем математической обработки параметров атомных орбиталей при соблюдении принципов квантовой химии были рассчитаны гибридизованные орбиты. Они имеют направленный характер и более выгодны геометрически для образования связей, так как эффективнее перекрываются с орбитами электронов других атомов и образуют более прочные связи.
sp3-гибридзация наблюдается при образовании углеродом 4-х простых связей. Наиболее устойчивое расположение гибридных орбиталей такое, когда оси электронных облаков направлены из центра тетраэдра к его вершинам, то есть располагаются под углами 109о28/ (тетраэдрическое строение). При этом силы отталкивания электронов наименьшие.



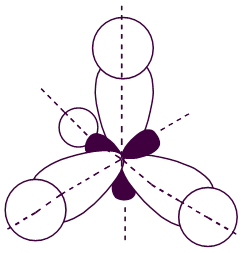
Рисунок 3
Электронное строение молекулы метана
Область максимального перекрывания электронной плотности при образовании связей совпадает с прямой, соединяющей ядра атомов. Такие связи называются s-связями, а электроны, их образующие, - s-электронами.
При образовании двойной связи каждый атом углерода соединяется с тремя другими атомами
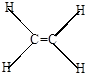
поэтому гибридизуются три электрона углерода – один s-электрон и 2 р-электрона (sр2-гибридизации). Наиболее симметричное расположение 3-х sp2-гибридных орбит достигается при размещении их осей в одной плоскости под углом 120о друг к другу (плоскостно-тригональная структура). Химические связи. образующиеся при взаимодействии гибридных орбиталей друг с другом и с s-электронами водорода, относятся к s-связям.
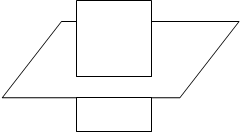 |

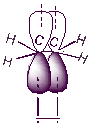
Рисунок 4
Электронное строение молекулы этилена
р-орбиталь углерода, не участвующая в гибридизации, располагается перпендикулярно плоскости, на которой находятся ядра атомов. В результате бокового перекрывания негибридизованных
р-орбиталей выше и ниже плоскости s-связей образуется вторая связь между атомами углерода. Такой вид связи получил название p-связи. Электроны, ее образующие, называются p-электронами.
При образовании тройной связи атом углерода соединяется только с двумя другими атомами Н-С С-Н. Поэтому гибридизуются только два электрона: один s-электрон и один р-электрон (sp-гибридизация). Два гибридных облака, симметрично расположенные под углом 180о друг к другу, образуют s-связи. Оставшиеся два р-электрона располагаются под углом 90о друг к другу и к оси s-связей. При их боковом перекрывании образуются две p-связи.
С-Н. Поэтому гибридизуются только два электрона: один s-электрон и один р-электрон (sp-гибридизация). Два гибридных облака, симметрично расположенные под углом 180о друг к другу, образуют s-связи. Оставшиеся два р-электрона располагаются под углом 90о друг к другу и к оси s-связей. При их боковом перекрывании образуются две p-связи.






Рисунок 5
Электронное строение молекулы ацетилена
Таким образом, в органических соединениях углерод может существовать в трех состояниях: sp3, sp2, sp-гибридизациях. s -электроны прочно связаны с ядром, поэтому s-связь отличается высокой прочностью и малой поляризуемостью. p –электроны слабее связаны с ядрами атомов,
p-связи отличаются малой прочностью и высокой поляризуемостью.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 481; Нарушение авторских прав?; Мы поможем в написании вашей работы!