
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
I тип. Реакция замещения
|
|
|
|
1. Реакции галоидирования. Самый энергичный реагент – фтор. Прямое фторирование приводит к взрыву. Наибольшее практическое значение имеют реакции хлорирования. Они могут протекать под действием молекул хлора на свету уже при комнатной температуре. Реакция протекает по свободно-радикальному цепному механизму и включает следующие основные стадии:
а) первая медленная стадия – инициирование цепи:
Cl: Cl 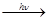 Cl. + Cl.
Cl. + Cl.
R: H + . Cl  HCl + R.
HCl + R.
б) развитие цепи – образование продуктов реакции с одновременным образованием свободных радикалов, продолжающих цепной процесс:
R. + Cl: Cl  RCl + Cl.
RCl + Cl.
R: H + Cl.  HCl + R.
HCl + R.
в) обрыв цепи:
R. + Cl.  RCl
RCl
Так как СI. реагент активный, он может атаковать молекулу уже полученного хлорпроизводного, в результате образуется смесь моно- и полигалогенозамещенных. Например:
CH4 + Cl2  HCl + CH3Cl
HCl + CH3Cl 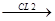 CH2Cl2
CH2Cl2  CHCl3
CHCl3  ССl4
ССl4
хлористый метил –HCl -HCl -HCl
хлористый метилен хлороформ четырех-
хлористый углерод
Реакция бромирования протекает значительно труднее, т.к. бром менее активен, чем хлор и реагирует в основном с образованием более устойчивых третичных или вторичных радикалов. При этом второй атом брома вступает обычно в соседнее с первым положение, преимущественно у вторичного углерода.

|
+ Br2 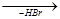
| 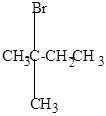
| 
| 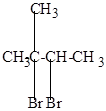
|
| изопентан | бромистый изопентан (2-бром-2-метилбутан) | 2,3-дибром-2-метилбутан |
Реакции иодирования практически не протекают, т.к. HI восстанавливает образующиеся йодистые алкилы.
2. Нитрование – замещение атома Н на группу NО2 при действии азотной кислоты. Идет при действии разбавленной азотной кислоты (12%) при высокой температуре 150оС под давлением (реакция Коновалова). Легче реагируют парафины изостроения, т.к. замещение легче происходит у третичного атома углерода:

|
+ HONO2  H2O + H2O +
| 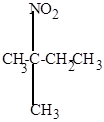
|
| изопентан | 2-нитро-2-метилбутан |
Механизм реакции нитрования связан с промежуточным образованием свободных радикалов. Инициированию способствует протекающий частично процесс окисления:
RH + HONO2  ROH + HONO
ROH + HONO
азотистая кислота
HONO + HONO2  HOH + 2 . NO2
HOH + 2 . NO2

|
+ . NO2 
|
H.
CH3-C-CH3 + . NO2  CH3-C-CH3 + HNO2
CH3-C-CH3 + HNO2
CH3 CH3
. NO2
CH3-C-CH3 + . NO2  CH3-C-CH3
CH3-C-CH3
CH3 CH3
т.е. радикальная реакция нитрования углеводородов не имеет цепного характера.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 420; Нарушение авторских прав?; Мы поможем в написании вашей работы!