
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакции присоединения
|
|
|
|
Химические свойства олефинов
Физические свойства олефинов
1. Температура кипения олефинов немного ниже (на 5-15оС) температуры кипения соответственных предельных углеводородов. Увеличивается с возрастанием молекулярного веса. Олефины с углеродной цепью С2 – С4 – газ; С5 – С16 – жидкости; С17 и более – твердые вещества.
а. Ткип нормальных изомеров выше, чем разветвленных;
б. Ткип цис-изомеров выше, чем транс-изомеров;
в. Ткип увеличивается при перемещении двойной связи ближе к центру.
2. Температура плавления также зависит от строения. Она выше у транс-изомеров и увеличивается при перемещении двой ной связи ближе к центру.
3. Плотность олефинов несколько выше, чем у парафинов (т.к. больше относительное содержание более тяжелого углерода).
d204C5H12 = 0,626 d204C5H10 = 0,641
4. Олефины растворяются в воде незначительно, но лучше, чем парафины. Растворимость увеличивается с увеличением полярности углеводорода. Олефины хорошо растворяются в растворах солей тяжелых металлов, например, в растворе CuCl (вследствие комплексообразования).
5. Оптические свойства. Олефины имеют более высокий показатель преломления, что говорит об их более высокой поляризуемости.
6. Олефины дают избирательное поглощение в инфракрасной области (1670 – 1560 см-1 и 100 – 830 см-1). В УФ-области олефины дают поглощение при 180-200 нм.
Химические свойства олефинов обусловлены природой двойных связей.
1) Двойная связь состоит из неравноценных связей: d-связи и p-связи. p-связь отличается от d-связи меньшей прочностью и большей поляризуемостью. Благодаря малой прочности p-связь легко разрывается. Этим обуславливается способность олефинов вступать в реакции присоединения.
2) В зависимости от характера реагента и условий проведения реакции могут идти или по гомолитическому, или по гетеролитическому механизму.
3) Благодаря легкой поляризуемости p-электронов и их способности захватывать положительные частицы. большинство реакций олефинов протекают по гетеролитическому электрофильному механизму.
 1. Присоединение водорода происходит при действии молекулярного водорода СН2=СН2 + Н2 Ni, Pt, Pd СН3-СН3. Эта реакция гетерогенного катализа протекает на поверхности твердого катализатора. включает в себя три этапа:
1. Присоединение водорода происходит при действии молекулярного водорода СН2=СН2 + Н2 Ni, Pt, Pd СН3-СН3. Эта реакция гетерогенного катализа протекает на поверхности твердого катализатора. включает в себя три этапа:
1) адсорбция молекул из газовой фазы на поверхности катализатора;
2) взаимодействие молекул в адсорбированном состоянии;
3) десорбция продуктов реакции с поверхности катализатора.
Катализаторы – металлы: Fe, Co, Ni, Pt, Pd, имеющие d-уровни, не полностью заполненные электронами. за счет чего могут обраховываться донорно-акцепторные связи с олефинами; происходит хемосорбция олефинов на поверхности катализатора. Молекулы водорода тоже хемосорбируются с металлами в виде свободных атомов.




 Н СН2 СН2 Н
Н СН2 СН2 Н
| Ni |
Скорость реакций зависит от поверхности катализатора, величины его частиц, а также от количества активных центров на поверхности катализатора (которыми являются дефекты кристаллической решетки), на них начинаетя реакция. Скорость гидрирования олефинов зависит от разветвленности цепи. Чем больше заместителей. тем труднее протекает реакция (т.к. слабее адсорбция).
2. Присоединение галогенов.
F2 – присоединяется со взрывом;
Cl – на рассеянном свету или при низкой температуре в присутствии катализатора FeCl3;
Br2 – при комнатной температуре в полярных растворителях;
I – медленно в полярных растворителях.
Механизм реакций может быть и электрофильным, и свободнорадикальым.
Электрофильное присоединение происходит под действием полярных растворителей. Молекула галогена поляризуется Brd+ Brd- под действием Н2О. При взаимодействии ее с олефинами наблюдается последовательноеобразование p-комплекса и d-комплекса.
Brd- под действием Н2О. При взаимодействии ее с олефинами наблюдается последовательноеобразование p-комплекса и d-комплекса.
CH2=CH2 + Brd+ Brd-
Brd- CH2=CH2
CH2=CH2  CH2-CH2 + Br
CH2-CH2 + Br CH2-CH2
CH2-CH2
Brd+ Brd- Br Br Br
Brd- Br Br Br
p-комплекс d-комплекс 1, 2-дибромэтан
p-комплекс образуется за счет захвата p-электронами положительного конца диполя молекулы галогена, затем образуется d-комплекс за счет обобщения атомом брома p-электронной пары с образованием d-связи. Одновременно происходит отщепление аниона брома. Затем карбокатион присоединяет анион брома. Таким образом, наблюдается ступенчатое присоединение двух атомов галогена.
Свободнорадикальное присоединение наблюдается при действии газообразного галогена в отсутствии растворителя на свету или при нагревании.
И: инициирование Cl2 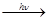 2Cl
2Cl
Ц: цепь CH2=CH2 + Cl.  CH2-CH2.
CH2-CH2.
Cl
CH2-CH2. + Cl2  CH2-CH2 + Cl.
CH2-CH2 + Cl.
Cl Cl Cl
О: обрыв цепи CH2-CH2. + Cl.  CH2-CH2
CH2-CH2
Cl Cl Cl
3. Присоединение галогеноводородов
Легкость присоединения возрастает от НСl HI, т.к. увеличивается поляризуемость молекул реагента. НF вызывает реакции полимеризации, его присоединение наблюдается только при назких темпратурах. Механизм реакций – электрофильный. HCl  H++ Cl-.
H++ Cl-.
Молекула олефина легко захватывает электрофильный реагент Н+ p-электронами (образуется p-комплекс), затем происходит образование
d-связи с Н+ за счет p-электронов (образуется d-комплекс),
CH2=CH2 + H+  CH2=CH2
CH2=CH2  CH3-CH2+
CH3-CH2+ 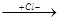 CH3CH2Cl
CH3CH2Cl
H+
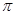 -комплекс
-комплекс 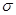 -комплекс хлористый этил
-комплекс хлористый этил
(карбкатион)
который стабилизируется за счет присоединения аниона хлора.
Если молекула содержит при ненасыщенном углероде какой-либо заместитель СН2=СН-Х, то место присоединения Н+ определяется природой заместителя. Все заместители делятся на две группы: электронодонорные (несущие избыток электронов и подающие их в цепь) и электроноакцепторные (имеющие недостаток электронов и притягивающие к себе p-электроны двойной связи).
Все углеводородные радикалы: СН3, С2Н5 и т.д. являются группами электронодонорными,
H
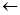 С
С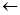 Н
Н
H
и отталкивают подвижные p-электроны двойной связи.
Например:
CH2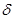 -=СН
-=СН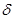 +
+ СН3
СН3
пропилен
В результате наиболее высокая электронная плотность создается у группы СН2; к ней и будет присоединяться протон.
CH2 -=СН
-=СН СH3 + H+
СH3 + H+  CH3-CH+-CH3
CH3-CH+-CH3  CH3-CH-CH3
CH3-CH-CH3
Cl
карбкатион хлористый изопропил
Таким образом, присоединение галогеноводородов к олефинам идет по правилу Марковникова: водород присоединяется к наиболее гидрированному атому углерода.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 606; Нарушение авторских прав?; Мы поможем в написании вашей работы!