
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ацетиленовых углеводородов
|
|
|
|
1. Алкилирование ацетилена, т.е. замена водорода на алкил.
CH CH + Na
CH + Na  ½ H2 + CH
½ H2 + CH C-Na
C-Na
(NH3 жидкий)
СH C-Na + ClCH3
C-Na + ClCH3  NaCl + CH
NaCl + CH C-CH3
C-CH3
Можно получить алкилированный ацетилен с помощью магнийорганических соединений (реакция Иоцича)
CH3
+Br-CH-CH3
CH CH + CH3MgBr
CH + CH3MgBr  CH4 + CH
CH4 + CH C-MgBr
C-MgBr  MgBr2 + CH
MgBr2 + CH C-CH-CH3
C-CH-CH3
CH3 2. Дегидрогалогенирование геминальных и вицинальных дигалогенопроизводных.
H Cl
H-C-C-H 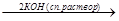 CH
CH CH
CH
H Cl -2HCl
Хлористый этилиден (геминальное дигалогенопроизводное)
H Cl
H-C-C-CH3  CH
CH C-CH3
C-CH3
Cl H -2HCl
Хлористый пропилен (вицинальное строение)
3. Электронное строение ацетиленовых углеводородов (см. электронное представление о природе химической связи)
В молекуле ацетилена каждый атом углерода соединяется только с двумя другими атомами: Н-С С-Н. Поэтому в гибридизации участвуют 2 электрона, один – s и один р – электрон, образуя в результате две гибридные орбитали. Происходит sp‑гибридизация. Наиболее устойчивое состояние молекулы достигается при наиболее симметричном расположении этих двух sp-орбиталей, т.е. под углом 180о друг к другу, образуя s-связи С-С и С-Н.
С-Н. Поэтому в гибридизации участвуют 2 электрона, один – s и один р – электрон, образуя в результате две гибридные орбитали. Происходит sp‑гибридизация. Наиболее устойчивое состояние молекулы достигается при наиболее симметричном расположении этих двух sp-орбиталей, т.е. под углом 180о друг к другу, образуя s-связи С-С и С-Н.
Рисунок 11. s-связи в молекуле ацетилена
В двух взаимно перпендикулярных плоскостях к оси s-связей располагаются электронные орбитали 2-х негибридизированных
р-электронов, за счет бокового перекрывания которых образуются 2
p-связи.
Рисунок 12. 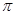 -связи в молекуле ацетилена
-связи в молекуле ацетилена
4 атома расположены на прямой, т.е. молекула ацетилена имеет линейное строение. Наблюдается значительное укорочение С С связи, длина которой составляет 1,20 А0.
С связи, длина которой составляет 1,20 А0.
Благодаря наличию двух пар подвижных 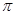 -электронов тройная связь легко поляризуется за счет влияния заместителей. Например, для метилацетилена
-электронов тройная связь легко поляризуется за счет влияния заместителей. Например, для метилацетилена
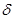 +
+ 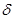 -
-
СН3 С
С СН.
СН.
Энергия тройной связи С С составляет 199,6 ккал/моль, т.е. намного меньше, чем у трех простых связей С-С (3.79=237).
С составляет 199,6 ккал/моль, т.е. намного меньше, чем у трех простых связей С-С (3.79=237).
4. Физические свойства.
1) Ацетиленовые углеводороды имеют несколько более высокие Ткип. и d204, чем олефины.
| Название | Ткип. , 0С | d204 |
| 1-бутин | 8,5 | 0,678 |
| 1-бутен | 6,3 | 0,630 |
2) Агрегатное состояние: С2-С3 - газы
С4-С16 – жидкости
С17 и более – твердые вещества
3) Заметно растворимы в воде (1 объем С2Н2 на 1 объем воды)
4) Смесь ацетилена с воздухом взрывоопасна в широких пределах
5. Химические свойства
Благодаря малой прочности 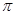 -связей ацетиленовые углеводороды легко вступают в реакции присоединения, окисления, полимеризации, идущие с разрывом
-связей ацетиленовые углеводороды легко вступают в реакции присоединения, окисления, полимеризации, идущие с разрывом 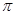 -связей. Механизм этих реакций чаще всего ионный: электрофильный или нуклеофильный, благодаря легкой поляризуемости тройной связи. Ацетилены, имеющие незамещенный Н у ненасыщенного атома углерода, способны замещать его на и некоторые другие металлы, т.е. проявляют кислотные свойства. Наличие кислотных свойств обусловлено природой тройной связи, у которой большая часть электронной плотности валентных электронов углерода сосредоточена между ядрами углерода, а внешние области обеднены электронами, поэтому углерод сильнее притягивает к себе электронную пару от водорода.
-связей. Механизм этих реакций чаще всего ионный: электрофильный или нуклеофильный, благодаря легкой поляризуемости тройной связи. Ацетилены, имеющие незамещенный Н у ненасыщенного атома углерода, способны замещать его на и некоторые другие металлы, т.е. проявляют кислотные свойства. Наличие кислотных свойств обусловлено природой тройной связи, у которой большая часть электронной плотности валентных электронов углерода сосредоточена между ядрами углерода, а внешние области обеднены электронами, поэтому углерод сильнее притягивает к себе электронную пару от водорода.
Н С – С
С – С  Н
Н
I. Реакции присоединения:
1) Гидрирование.
СН СН + Н2
СН + Н2 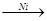 СН2=СН2
СН2=СН2 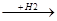 СН3-СН3
СН3-СН3
Сначала идет гидрирование с разрывом 1 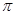 -связи до образования этилена, а затем уже образуется метан. Ацетиленовые углеводороды легче адсорбируются на поверхности катализатора, поэтому реакция идет избирательно: сначала I стадия, затем II стадия.
-связи до образования этилена, а затем уже образуется метан. Ацетиленовые углеводороды легче адсорбируются на поверхности катализатора, поэтому реакция идет избирательно: сначала I стадия, затем II стадия.
2) Реакции электрофильного присоединения галогенов и галогеноводородов происходят также ступенчато.
Br Br
СН СН + Br2
СН + Br2  CН=СН
CН=СН  CН-СН
CН-СН
Br Br Br Br
дибромэтилен тетрабромэтилен
СН СН + НСl
СН + НСl  CН2=СН-Сl
CН2=СН-Сl 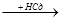 CН3СНCl2
CН3СНCl2
хлорвинил хлористый этилиден
Присоединение ННаl протекает в соответствии с правилом Марковникова. Если возьмем метилацетилен, то 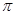 -связь поляризована:
-связь поляризована:
СН3 С
С СН + Н+
СН + Н+  СН3-С-СН2
СН3-С-СН2 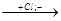 СН3-С=СН2
СН3-С=СН2
Сl
4) Реакции нуклеофильного присоединения:
а) присоединение спиртов:
СН3ОН + КОН  СН3ОК + Н2О
СН3ОК + Н2О
Спирт в присутствии твердого КОН образует алкоголят, который диссоциирует с образованием аниона
СН3ОК  СН3О- + К+
СН3О- + К+
СН3О- - нуклеофильный реагент, вызывает протекание реакции по нуклеофильному механизму
СН СН + СН3О-
СН + СН3О-  СН=СН-ОСН3
СН=СН-ОСН3 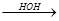 СН2-СН-О-СН3 + ОН-
СН2-СН-О-СН3 + ОН-
б) присоединение HCN
CН СН + Н-С
СН + Н-С N
N  СН2=СН-С
СН2=СН-С N
N
акрилонитрил
также протекает по нуклеофильному механизму
СН СН + CN-
СН + CN-  СН=СН-СN
СН=СН-СN 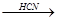 CН2=СН-CN + CN-
CН2=СН-CN + CN-
Протеканию реакции способствует наличие ионов СN- (источником которых является катализатор). Реакции нуклеофильного присоединения протекают труднее при наличии электроно-донорных заместителей.
в) присоединение уксусной кислоты
О
СН СН + СН3-С
СН + СН3-С 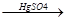 СН2=СН-О-С-СН3
СН2=СН-О-С-СН3
О
винилацетат – мономер, используется
в производстве ПВС
4) Гидратация ацетиленовых углеводородов (реакция Кучерова)
Н
СН СН + НОН
СН + НОН  СН2=СН
СН2=СН СН3-С
СН3-С
ОН уксусный альдегид
самопроизвольная
изомеризация
II. Реакции окисления
Хорошо окисляются сильными окислителями за счет разрыва тройной связи с образованием двух молекул карбоновых кислот
СН3-С С-СН2-СН3 + 3О + Н2О
С-СН2-СН3 + 3О + Н2О  СН3-С=О + СН3-СН2-С=О
СН3-С=О + СН3-СН2-С=О
ОН ОН
Метилэтилацетилен (КМnО4) уксусная пропионовая
кислота кислота
Если тройная связь у конца цепи, то образуется одна молекула карбоновой кислоты и СО2.
СН3-СН2-С СН + 4О
СН + 4О  СН3-СН2-СООН + СО2
СН3-СН2-СООН + СО2
пропионовая кислота
III. Реакции полимеризации и конденсации
Ацетилен легко образует низкомолекулярные полимеры. В зависимости от условий реакция полимеризации может привести к образованию различных продуктов.
1. Образование ароматических углеводородов.
СН
НС СН
НС СН 

высокая температура
СН пропуск через раскаленные трубки
2. Циклическая полимеризация 4-х молекул происходит в присутствии карбонила никеля:
СН СН
СН
СН СН
СН СН 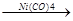
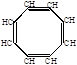
СН СН
СН
3. Линейная ступенчатая полимеризация.
СН СН+СН
СН+СН СН
СН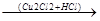 СН2=СН-С
СН2=СН-С СН
СН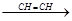 СН2=СН-С
СН2=СН-С С-СН=СН2
С-СН=СН2
винилацетилен дивинилацетилен
4. Конденсация с альдегидами или кетонами
а) реакция Фаворского
СН3 СН3
СН СН + С-СН3
СН + С-СН3  СН
СН С-С-СН3
С-С-СН3
О ОН
диметилацетиленилкарбинол
б) реакция Реппе
СН СН+СН2
СН+СН2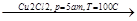 СН=СН-СН2
СН=СН-СН2 СН2-СН=С-СН2
СН2-СН=С-СН2
О ОН ОН ОН
пропинол бутиндиол
пропаргиловый спирт
IV. Реакции замещения водорода металлом – образование ацетиленидов
1. Образование ацетиленидов щелочных и щелочно-земельных металлов.
а) взаимодействие с металлическим натрием;
б) взаимодействие с Мg-органическими соединениями:
СН3-С СН+С2Н5МgBr
СН+С2Н5МgBr  C2Н6 + СН3-СН=СН-MgBr
C2Н6 + СН3-СН=СН-MgBr
1-пропенилмагнийбромид
(реакция Иоцича)
2. Взаимодействие с гидроокисями или солями тяжелых металлов:
СН СН + 2[Ag(NH3)2]ОН
СН + 2[Ag(NH3)2]ОН Ag-C
Ag-C C-Ag + 4NH3 + 2H2O
C-Ag + 4NH3 + 2H2O
грязно-белый осадок
СН СН + 2[Cu(NH3)2]ОН
СН + 2[Cu(NH3)2]ОН  Cu-C
Cu-C C-Cu + 4NH3 + 2H2O
C-Cu + 4NH3 + 2H2O
красный осадок
Ацетилениды тяжелых металлов водой не разлагаются, мало химически активны, но в сухом виде взрывчаты (ацетилен нельзя пропускать через медные трубы). Реакции образования ацетиленидов металлов применяются для качественного и количественного определения углеводородов с концевой тройной связью.
Отдельные представители: ацетилен, винилацетилен.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 1096; Нарушение авторских прав?; Мы поможем в написании вашей работы!