
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Застосування принципу Ле Шательє
|
|
|
|
Вплив тиску на стан рівноваги
Вплив температури на стан рівноваги
Вплив концентрації на стан рівноваги
Вплив різних факторів на хімічну рівновагу
| Впливаючий фактор | К рівноваги | Стан рівноваги | Швидкість досягнення рівноваги |
| Зміна концентрації | не змінюється | змінюється | змінюється |
| Зміна тиску | не змінюється | змінюється | змінюється |
| Наявність каталізатора | не змінюється | не змінюється | змінюється |
| Зміна температури | змінюється | змінюється | змінюється |
| К рівноваги не залежить: ü від концентрації; ü від тиску; ü від наявності каталізатора (прискорює встановлення рівноваги); ü від енергії активації (впливає на час встановлення рівноваги). | К рівноваги залежить: þ від температури: Для екзотермічних реакцій (∆Н<0):Т↑, Крівн↓; Для ендотермічних реакцій (∆Н>0): Т↑, Крівн↑; þ від природи реагуючих речовин (для кожної реакції Крівн=const). |
| Система перебуває в стані хімічної рівноваги, якщо: o швидкість прямої реакції дорівнює швидкості зворотної реакції; o в системі не відбуваються ніякі зміни; o система є ізольованою. |
Змінюючи умови, можна перевести систему з одного рівноважного стану в інший.
Перехід системи від одного стану рівноваги до іншого – зміщення хімічної рівноваги.
Принцип Ле Шательє (1884): якщо на систему, що перебуває в стані рівноваги, впливати ззовні, то рівновага зміщується у бік тієї реакції, що послаблює цей вплив.
| Реакція | Концентрація реагентів | Концентрація продуктів |
| Пряма | збільшення | зменшення |
| Зворотна | зменшення | збільшення |
| Пряма реакція | Підвищення температури | Зниження температури |
| Екзотермічна | рівновага зміщується вліво (відбувається зворотна реакція) | рівновага зміщується вправо (відбувається пряма реакція) |
| Ендотермічна | рівновага зміщується вправо (відбувається пряма реакція) | рівновага зміщується вліво (відбувається зворотна реакція) |
| Пряма реакція | Збільшення тиску | Зменшення тиску |
| Зі збільшенням об’єму | Рівновага зміщується вліво (відбувається зворотна реакція) | Рівновага зміщується вправо (відбувається пряма реакція) |
| Зі зменшенням об’єму | Рівновага зміщується вправо (відбувається пряма реакція) | Рівновага зміщується вліво (відбувається зворотна реакція) |
Запишіть вираз для константи рівноваги оборотної реакції: 2SО2 + О2 ↔ 2 SO3, ∆Н<0
Якими способами можна змістити рівновагу даної реакції в бік прямої реакції?
Розв’язок:
Реакція оборотна, екзотермічна (∆Н<0), супроводжується зменшенням об’єму системи (кількість молей реагентів – 3, продуктів – 2).
Крівн = 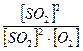
Щоб змістити рівновагу в бік прямої реакції необхідно:
³ Збільшувати концентрації вихідних речовин SO2 та О2, зменшувати концентрації продуктів SO3.
³ Знижувати температуру (реакція екзотермічна).
³ Підвищувати тиск (реакція супроводжується зменшенням об’єму).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 928; Нарушение авторских прав?; Мы поможем в написании вашей работы!