
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Отличие в свойствах
|
|
|
|
ПРЕДЕЛЬНЫЕ ДВУХОСНОВНЫЕ КИСЛОТЫ
ЛЕКЦИЯ 12
| HOOC-COOH | щавелевая | этандионовая |
| HOOC-CH2-COOH | малоновая | пропандионовая |
| HOOC-CH2-CH2-COOH | янтарная | и т.д. |
| OOC-(CH2)3-COOH | глутаровая | |
| OOC-(CH2)4-COOH | адипиновая |
1. Кислотные свойства более сильные. Степень диссоциации тем выше, чем ближе две группы СООН.
К1 щавелевая = 3,8.10-2
К1 адипиновая = 3,9.10-5
2. Образуют кислые и средние соли, полные и неполные амиды, хлорангидриды, сложные эфиры.
3. Неустойчивы к нагреванию - разлагаются
а) щавелевая и малеиновая кислоты отщепляют СО2 (декарбоксилируются) с образованием одноосновных кислот.
HOOC-COOH  CO2 + HCOOH
CO2 + HCOOH
б) янтарная и глутаровая кислоты образуют циклические ангидриды
O O
CH2-C CH2-C
OH O
OH  H2O + CH2-C
H2O + CH2-C
CH2-C O
O
в) адипиновая кислота и следующие при нагревании отщепляют и СО2, и воду, образуя циклические кетоны.
O
CH2-CH2-C
OH CH2-CH2
OH  CO2 + H2O + C=O
CO2 + H2O + C=O
CH2-CH2-C CH2-CH2
O циклопентанон
Реакция идет легче, если взять кальциевую соль кислоты (выделяется СаСО3).
4. Двухосновные кислоты, в отличие от одноосновных, могут окисляться.
 O CO2
O CO2
 HO-C=O
HO-C=O  CO2 + HO-C
CO2 + HO-C
HO-C=O OH H2O
5. Малоновая кислота отличается особой подвижностью атомов водорода в метиленовом мостике. Н – приобретает способность замещаться. Например, диэтиловый эфир малоновой кислоты при действии металлического натрия дает замещение Н на Na.
+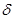 H +
H +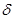
HOOC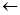 C
C COOH
COOH
H
O O
C C
OC2H5 OC2H5
2CH2 + 2Na  H2
H2 + 2 CHNa
+ 2 CHNa
O O
C C
OC2H5 OC2H5
натриймалоновый эфир
На его основе получают различные кислоты, например,
COOC2H5 COOC2H5
CHNa + Br-CH2-CH3  NaBr + CH-CH2-CH3
NaBr + CH-CH2-CH3 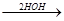
COOC2H5 COOC2H5 -2C2H5OH
O
C
OH
 CH-CH2-CH3
CH-CH2-CH3  CO2 + CH3-CH2-CH2-COOH
CO2 + CH3-CH2-CH2-COOH
O масляная кислота
C
OH
6. Поликонденсация двухосновных кислот с двухатомными спиртами и диаминами
O O O O
nC-(CH2)4-C +n HO-CH2-CH2-OH  n H2O + (-C-(CH2)4-C-O-CH2-CH2-O-)n
n H2O + (-C-(CH2)4-C-O-CH2-CH2-O-)n
HO OH
адипиновая килота этиленгликоль этиленгликольадипинат
O O O O
nC-(CH2)4-C + nH2N-(CH2)6-NH2  nH2O + (-C-(CH2)4-C-NH-(CH2)6-NH-)n
nH2O + (-C-(CH2)4-C-NH-(CH2)6-NH-)n
HO OH
полиамиды (найлон 66)
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 424; Нарушение авторских прав?; Мы поможем в написании вашей работы!