
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
I. Реакции в нитрогруппе.
Восстановление соединений
CH3NO2 + 6H  CH3NH2 + 2H2O
CH3NH2 + 2H2O
II. Реакции в радикале.
Происходят за счет подвижных атомов водорода в 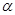 -положении к нитрогруппе. Такие реакции имеют место только у первичных и вторичных нитросоединений.
-положении к нитрогруппе. Такие реакции имеют место только у первичных и вторичных нитросоединений.
1) Взаимодействие со щелочами. Протекает благодаря способности нитросоединений образовывать таутомерные аци-формы.
H O O O
CH3-C-N 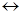 CH3-CH=N
CH3-CH=N  CH3-CH=N + H2O
CH3-CH=N + H2O
H O OH ONa
Нитро-форма аци-форма
Нейтральные соединения, но со щелочами образуют соли с выделением воды. Ганч назвал такие соединения псевдокислотами. К псевдокислотам относятся первичные и вторичные нитросоединения.
CH3 O CH3 O O
CH3-CH-N 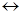 CH3-C=N
CH3-C=N  (CH3)2C=N + H2O
(CH3)2C=N + H2O
O OH ONa
2) Действие азотистой кислоты
а) первичные нитросоединения с HNO2 образуют нитроловые кислоты.
O O O O
CH3-CH-N + HO-N=O  CH3-CH-N
CH3-CH-N 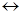 CH3-C-N
CH3-C-N  CH3-C-N
CH3-C-N
O N=O O N-OH O N-ONa O
Нитроэтан нитроловая кислота таутомерная форма
нитроловой кислоты
Нитроловая кислота также способна образовывать таутомерные формы, которые обладают кислотными свойствами и реагируют со щелочами с образованием соли, окрашенной в красный цвет. Это качественная реакция на первичные и нитросоединения.
б) вторичные нитросоединения с HNO2 образуют псевдонитролы.
O N=O O
СH3-CH-N + HO-N=O  H2O + CH3-C - N
H2O + CH3-C - N
CH3 O CH3 O
Псевдонитрол
Раствор псевдонитрола в эфире, а также расплав имеют бирюзовую окраску (качественная реакция вторичных нитросоединений).
3) Конденсация нитросоединений с альдегидами и кетонами
O O OH O O
CH3-C + CH3-CH2-N  CH3-C-CH-N
CH3-C-CH-N  H2O + CH3-CH=C-N
H2O + CH3-CH=C-N
H O H CH3 CH3 O
уксусный нитроэтан 3-нитро-2-бутанол 2-нитро-2-бутен
альдегид
Нитроолефины используются в производстве полименых материалов.
При избытке альдегида могут образовываться многоатомные нитроспирты.
O
HC
H
O H HO-CH2 O2NOCH2
HC + H-C-NO2  HO-CH2-C-NO2 + 3HONO2
HO-CH2-C-NO2 + 3HONO2  O2NOCH2-C-NO2
O2NOCH2-C-NO2
H H HO-CH2 O2NOCH2
O нитрометан триоксиметил тетрит (ВВ)
HC (нитрометан)
H
Формальдегид
4) Действие галогенов
СH3-CH2-NO2 + 2Br2  CH3-CBr2-NO2 + 2HBr
CH3-CBr2-NO2 + 2HBr
нитроэтан 1,1-дибром -1-нитроэтан
3. Отличие химических и физических свойств нитросоединений от свойств изомерных сложных эфиров азотистой кислоты, т.е.
O
R-N R-O-N=O
O
нитропарафинов от алкилнитратов
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 761; Нарушение авторских прав?; Мы поможем в написании вашей работы!