
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Метал Аu Аg Сu Н Ni Fе Zn Аl Мg
|
|
|
|
Мал.39
Хімічна корозія характеризується товщиною і властивостями оксидної плівки, а також швидкістю протікання процесу. Товщина плівки визначається тривалістю процесу і температурою.
1.Товсті плівки (>5000 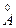 ) виявляються візуально;
) виявляються візуально;
2.Плівки середньої товщини (400 - 500 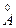 ) виявляються на
) виявляються на
металі у виді кольорів побіжності;
3.Тонкі плівки (< 400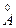 ) виявляються непрямим методом.
) виявляються непрямим методом.
З підвищенням температури швидкість дифузії газів збільшується і тому хімічна корозія протікає інтенсивніше з утворенням на поверхні металу товстої плівки оксидів, називаною окалиною.
Електрохімічна корозія являє собою процес руйнування металу в електроліті. Електролітами можуть бути водяні розчини солей, кислот, лугів, а також вода. Цей вид корозії є найбільш розповсюдженим. Більшість металевих конструкцій у процесі експлуатації знаходяться в зіткненні з повітрям. У повітрі знаходяться водяні пари, вуглекислота, сірчаний газ і інші домішки, що розчиняються в крапельках вологи. У результаті поверхня металевих конструкцій покрита вологою, насиченої солями, лугами і кислотами, тобто тонким шаром електроліту, у зв'язку з чим і виникає електрохімічна корозія.
Розглянемо процес електрохімічної корозії. При зануренні металу в електроліт, що представляє собою розчини солей того ж металу, одночасно будуть протікати два процеси:
- перехід атомів металу в розчин;
- зворотний процес переходу іонів металу з розчину на поверхню металу.
У залежності від співвідношення швидкостей протікання обох процесів можливі три різних випадки поводження металів в електроліті.
1-й випадок - швидкість переходу атомів металу в розчин менше швидкості переходу іонів металу з розчину на зразок.
У цьому випадку на поверхні зразка осаджуються позитивно заряджені іони металу. Зразок у цілому заряджається електрододатньо і процесу корозії не відбувається.
2-й випадок - швидкість переходу атомів у розчин дорівнює швидкості переходу іонів металу з розчину на поверхню зразка. У цьому випадку зразок металу залишається електронейтральним і процес корозії також не спостерігається.
3-й випадок - швидкість переходу атомів у розчин більше швидкості переходу іонів металу з розчину на зразок. У цьому випадку метал, віддаючи позитивні іони, заряджається електровід’ємно. При цьому відбувається розчинення металу, тобто протікає процес корозії.
Значить у випадку електрохімічної корозії кородуючий метал заряджається електровід’ємно. Якщо корозії не відбувається, то метал залишається електронейтральним чи заряджається електрододатньо. Кількісною характеристикою відносини металу до корозії є величина електрохімічного потенціалу, що різна для різних металів. За порядком убування електрохімічного потенціалу всі метали можуть бути розташовані в наступний ряд:
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 284; Нарушение авторских прав?; Мы поможем в написании вашей работы!