
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Уравнения Ван-дер-Ваальса для молекул реального газа, у которого часть объема молекул занято самими молекулами газа
|
|
|
|
Связь между скорости движения молеку с температурой и давлением газа
Уравнения Клаперона-Менделеева
В 1834 году Клайперон объединил закон Бойля – Мариотта и Гей-Люссака и получил уравнение PV/T = β = const
В 1875 г. Д.И. Менделеев, исходя из законов Клайперона и Авогадро получил общее выражение уравнения состояния газа, связывающее объем – V, давление Р, температуру Т, массу – м и молекулярную массу – М.
PV = m/M RT, где R – 8,32 дж/моль – газовая постоянная. Она равна работе по расширению газа при нагревании на 1˚К.
Связь между скоростью движения и давлением газа. Следует из элементарных соображений. При упругом ударе о стенку импульс силы будет равен удвоенному произведению ∆f • Δt = mV - (-mV) = 2 mV. Сложим все эти удары.
f = m/a ∑Vi2 = m/a N′u2, где u2 – средне квадратичная скорость молекул, a – сторона куба
или P = 2/3 n0 mu2/2 = 1/3 n0Ek Это уравнение Клаузиса
Давление газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Австрийский физик Л.Больцман исследовал зависимость кинетической энергии молекул от температуры и получил формулу на 3 степени свободы
Еk = 3/2 kT, k = 1,38 • 10-23 Дж/к Если i степеней, то Еk = ikT/2.
Если 1 степень свободы, то Ек = 3/2 kT/3 = kT/2 – постоянная Больцмана.
Средняя кинетическая энергия поступательного движения молекул идеального газа зависит от температуры. Соответственно подставим в уравнение Клаузиса кинетическую энергию Больцмана и получим зависимость давления от температуры.
Из уравнения Клайперона - Менделеева выводится формула Авогадро для одного моля газа
PVm = NAkT, откуда Vm = NAkT/P
Объем одного моля газа прямо пропорционален температуре и обратно пропорционален давлению.
Среднеквадратичная скорость молекул – u2. Найдем из формулы Больцмана.
Еk = mu2/2 = 3kT/2 или u2 = 3kT/m U = √3kT/m = √3RN/(NAm) = √3RT/m
Для данного газа средняя квадратичная скорость молекул пропорциональна корню квадратному из термодинамической температуры и зависит только от нее. Распределение молекул по скоростям движения исследовал Максвелл. Он получил формулу для наиболее вероятной скорости движения. Vb = √2RT/m
 (Р+a/V2 м) (Vм–в)=RТ
(Р+a/V2 м) (Vм–в)=RТ
Всякое вещество может быть газообразным, жидким и твердым.
Р
Vм
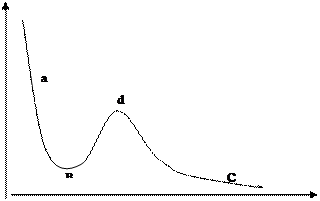
| Если сжимать жидкость, то можно получить состояние растянутой жидкости – ав, насыщенного пара – вd и парообразное состояние – dc. Для каждого вещества существует такая температура, выше которой газ не может превращаться в жидкость ни под каким давлением. Эта температура называется критической. Рис.19 График зависимости давления и объема для реального газа. |
Для земной атмосферы, находящейся в поле тяготения Земли, закономерно уменьшение температуры в среднем на –6,5 градуса при подъеме на 1км. В результате на высоте 10 км температура падает от +15 до –50 градусов. Далее падение температуры замедляется и на высоте несколько десятков км начинается повышение температуры с высотой. При том мизерном давлении это не ощутимо для человека и летательного аппарата. Просто молекулы воздуха носятся с большой скоростью, подгоняемые солнечным излучением и потоком частиц от Солнца (солнечный ветер), редко сталкиваясь и достигая скоростей нескольких км/сек. А повышение скорости дает повышение температуры, в соответствии с выше приведенной формулой Больцмана. При этом самые легкие атомы воздуха достигают второй космической скорости и убегают из атмосферы Земли, становясь микро планетами, заполняющими окрестности Солнца.
Давления с высотой уменьшается по барометрической формуле для Земли:
h = 8000*lg(Po/Ph) где h высота в метрах, Po, Ph – давление на уровне моря и заданной высоте. Таким образом, измерив, давление на возвышенности можно определить ее высоту, что на много проще чем пытаться измерить ее в метрах. В справочниках по Земной атмосфере приводятся более точные данные по изменению температуры и давления с высотой.
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 468; Нарушение авторских прав?; Мы поможем в написании вашей работы!
