
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислотно-основне титрування
|
|
|
|
Суть та класифікація. Вимоги до реакцій в титриметрії. Способи титрування: прямі та непрямі. Способи приготування стандартних розчинів. Техніка роботи. Методи визначення кінцевої точки титрування. Розрахунки в титриметрії.
Сутність методу. Методи виділення, відгонки, осадження. Осаджувана і гравіметрична форми, вимоги до них. Основні стадії методу осадження. Обчислення результатів у гравіметричному аналізі. Фактори перерахунку. Механізм процесу осадження. Процеси, які спричиняють забруднення осадів(спів осадження) та способи їх усунення. Оптимальні умови утворення кристалічних та аморфних осадів з метою їх використання у гравіметричному аналізі.
Гравіметрія (ваговий аналіз) – хімічний кількісний метод аналізу, заснований на точному вимірюванні маси визначуваної речовини, або її складових частин, які виділяються в хімічно чистому стані, чи у вигляді відповідних сполук точно відомого сталого складу.
Розрізняють такі методи гравіметрії:
1. Метод виділення при якому потрібний компонент отримують у вільному стані і точно зважують. Наприклад визначення золоту у сплаві, або золи у твердому паливі, біологічних об’єктах, препаратах, шляхом спалювання палива, або прожарювання проби. Розрахунок результатів аналізу виконується за формулою:
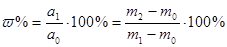 ,
,
де а0 – маса проби;
а1 – маса виділеного компоненту;
m0 – маса порожнього тиглю;
m1 – маса тиглю з наважкою;
m2 – маса тиглю після прожарювання.
2. Метод відгонки при якому визначаємий компонент видаляється у вигляді леткої сполуки. Кількість речовини визначають за зменшенням маси проби, або за збільшенням маси речовини, яка поглинає. Так визначають вологість реактивів, ґрунту, кількість летких речовин, висушуючи зразок до сталої маси при певній температурі. Результати розраховують за формулою:
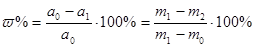 ,
,
де а0 – маса проби а0=m1-m0;
а1 – маса висушеної проби а1=m2-m0;
m0 – маса порожнього тиглю;
m1 – маса тиглю з наважкою;
m2 – маса тиглю після прожарювання.
З практичних даних маса наважки повинна бути такою, щоб маса сполука, що видаляється, складала біля 0,1 г.
3. Метод осадження засновано на осаджуванні визначуваного компоненту, або його складових частин хімічним засобом у вигляді малорозчинної сполуки певного складу дією осадника. Осад промивають, відділяють, висушують, прожарюють і зважують. З цих методів найбільш поширений метод осадження.
У методі осадження розрізняють форму осадження – речовина, яку осаджують із розчину, і гравіметричну форму(вагову) – сполука, яку зважують для отримання кінцевого результату. Ці форми можуть і не співпадати. Вагова форма повинна мати певний і відомий склад. Приклади гравіметричних визначень за методом осадження.
1. Визначення SO42-:
Ba2+ + SO42-  BaSO4
BaSO4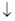 .
.
Визначувані компоненти Ba2+, S2-, SO42-. Осадник - BaCl2, Ba(NO3)2.
2.Визначення Fe3+:
2Fe3+ + 6OH-  2Fe(OH)3
2Fe(OH)3 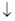
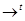 Fe2O3.
Fe2O3.
В.р. Осадник Форма осад. Вагова форма.
3.Визначення Ca2+
Ca2+ + C2O42-  CaC2O4
CaC2O4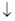
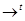 CaO + CO + CO2.
CaO + CO + CO2.
Визначення по методу осадження в загальному вигляді включають наступні етапи(після відбору і підготовки проби):
1.Взяття наважки. Маса наважки визначається методом і формою осаду. В полу мікроаналізі з практичних даних:
 ,
,
де mн - маса наважки, г,
МА, МВ - відповідно молярні маси аналізованої речовини і вагової форми, г/моль;
а,b - коефіцієнти рівняння реакції;
mВ.ф. - оптимальна маса вагової форми, що становить 0,5 г для кристалічних осадів і 0,1 г для аморфних осадів.
2.Розчинення наважки. Наважку розчиняють у воді, або у відповідному розчиннику при кімнатній температурі чи при підігріванні.
3.Осадження. Спочатку підбирають осадник, який по – перше, повинен бути специфічним(осаджувати визначуваний іон у присутності інших іонів), а по – друге форма осадження повинна мати добуток розчинності ДР<10-8, щоб забезпечити практично повне осадження. Кількість осадника розраховується з рівняння реакції, а для забезпечення повноти осадження береться 1,5 кратний надлишок. Для загальної реакції:
Визначувана речовина Осадник
аА вВ
аМА вМВ
mн mос.
moc. = 
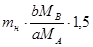 .
.
Об’єм розчину осадника концентрацією С і густиною 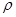 :
:
Voc. =  .
.
При осадженні додержуються відповідних правил, наприклад, осадник додають до розчину визначуваної речовини. Після осадження перевіряють повноту осадження додаючи 1-2 краплини розчину.
При необхідності осад залишають у маточному розчині для визрівання.
4.Фільтрування здійснюється через паперові беззольні фільтри різної щільності:
червона стрічка – найменш щільні;
біла стрічка – середньої щільності;
синя стрічка – найбільш щільні.
5.Промивання осаду здійснюють методом декантації дистильованою водою, або відповідним розчином, для видалення заважаючи іонів.
6.Промитий осад переводять у вагову форму шляхом висушування, озолювання і прожарювання до сталої маси.
7.Обчислення результатів у гравіметричному аналізу здійснюється за стехіометричним рівнянням схеми аналізу за формулами:
mВ.р = mВ.фF,
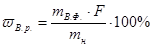 ,
,
де mВ.р. – маса визначуваної речовини, г;
mВ.ф. – маса вагової форми, г;
mн – маса наважки, г;
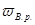 – масова частка визначуваної речовини, %;
– масова частка визначуваної речовини, %;
F – фактор перерахунку вагової форми на визначувану речовину. Він відшукується по таблицях, або визначається за формулою:
F=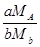 ,
,
де МА – молярна маса визначуваної речовини, г/моль,
МВ – молярна маса вагової форми, г/моль,
a,b –коефіцієнти, які зв’язують вміст визначуваної речовини у ваговій формі.
Наприклад, при визначені феруму за схемою:
2 Fe Fe2O3
2 MFe MFe2O3
mFe. mВ.ф.
Звідки:
mFe = mВ.ф.  , F =
, F = 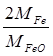 .
.
Процес утворення твердої фази у розчині складний і складається з таких основних стадій як: утворення первинних кристалів; їх агрегація і орієнтація; визрівання(старіння) осаду.
Утворення осаду можливо, якщо іонний добуток для даної реакції перевищує добуток розчинності при даній температурі, чи необхідно деяке пересичення розчину. Чим воно більше, тим більше утворюється первинних кристалів.
Агрегація – об’єднання первинних кристалів у більш крупні. Швидкість агрегації у першу чергу залежить від пересичення розчину.
Орієнтація – процеси, які сприяють утворенню добре сформованих відносно крупних кристалів. Співвідношення швидкості процесів агрегації і орієнтації обумовлює реальну структуру осаду.
Якщо превалює швидкість агрегації – утворюються аморфні осади; а якщо більше швидкість процесів орієнтації – утворюються добре сформовані кристалічні осади. Аморфні осади утворюють більшість гідроксидів і сульфідів металів, а кристалічні – прості полярні сполуки - BaSO4, AgCl.
Визрівання – необхідні структурні перетворення осадів, які залишені на деякий час у маточному розчині. Для кристалічних осадів ці змінення приводять до розчинення дрібних і росту крупних кристалів завдяки більшій розчинності дрібних кристалів і дифузії розчиненої речовини від дрібних кристалів до крупних. При цьому відбувається часткове самоочищення кристалів, перехід у розчин сторонніх іонів, які були захоплені осадом під час осадження і після осадження. Час визрівання продовжується 0,5-24 години.
Для аморфних осадів старіння призводить до утворення щільних, желеподібних і сильно забруднених структур, що заважає їх обробленню. Тому аморфні осади відфільтровуються безпосередньо після їх осадження. Структура осаду, таким чином, залежить: від концентрації речовини, що осаджується і осадника; тривалості осадження, температури, перемішування, розчинності осаду при даних умовах, рН середовища.
Швидкість утворення первинних кристалів і їх кількість залежать від пересичення розчину – чим воно більше, тим більше утворюється первинних кристалів. Тому при осаджені з концентрованих розчинів утворюються аморфні осади, а з розбавлених – кристалічні.
При повільному осаджені утворюються правильні крупні кристали, а при швидкому – з’являється багато центрів кристалізації і утворюється багато дрібних кристалів. Чим менше розчинність речовини, тим швидше утворюються осади і тим дрібніше кристали.
Перемішування сприяє зниженню високих місцевих концентрацій, кількість первинних кристалів зменшується і ростуть крупні кристали.
При підвищені температури розчинність осадів як правило збільшується і крупні кристали утворюються швидше. Тому осадження треба вести з гарячих розчинів гарячими розчинами осадника.
Джерелами помилок в гравіметричному осаджені, в першу чергу, є процеси спів осадження(спряженого осадження) – властивість деяких сполук, які добре розчинені у даному розчиннику, осаджуватися при утворені осаду одночасно з малорозчинною сполукою, що утворює осад.
Адсорбційне соосадження – поглинання з розчину домішок поверхнею осаду. Воно зменшується при підвищенні температури, концентрації речовини, при зменшені поверхні.
Окклюзія – захват домішок усією масою осаду, що утворюється. До оклюзії більш здатні кристалічні осади, особливо, якщо осад утворюється швидко.
Хімічне спів осадження – коли речовини, які утворюються при хімічній взаємодії часток осаду з адсорбованими на ньому домішками, осаджуються сумісно з основним осадом.
Ізоморфне спів осадження – явище утворення загальної кристалічної решітки двома або більше різними по складу речовинами.
Надійним засобом отримання чистих осадів є їх промивання у дистильованій воді, або відповідному розчинникові, а також повторне осадження(пере осадження) – розчинення осаду і наступне його повторне осадження.
Оптимальними умовами утворення кристалічних осадів з метою їх використання у гравіметричному аналізі є:
1.Вести осадження із досить розбавлених розчинів розбавленими розчинами осадника.
2.Додавати осадник повільно при перемішуванні розчину.
3.Вести осадження із гарячих розчинів гарячими розчинами осадника.
4.Додавати речовини, які збільшують розчинність первинних кристалів.
5.Надлишок осадника додавати по закінченню осадження.
6.Осадок певний час витримати для визрівання.
Оптимальними умовами утворення аморфних осадів є:
1.Вести осадження із досить концентрованих розчинів концентрованими розчинами осадника.
2.Додавати осадник швидко.
3.Вести осадження із гарячих розчинів гарячими розчинами осадника, що запобігає утворенню колоїдних розчинів.
4.Вести осадження у присутності електроліту-коагулятору(кислоти, солі амоніаку).
5.По закінченню осадження додати значний об’єм гарячої дистильованої води(~100мл), розчин перемішати. Це сприяє порушенню адсорбційної рівноваги і частина адсорбованих іонів переходить у розчин.
6.Осад швидко відфільтрувати, промити і висушити.
Контрольні питання до теми 2.2
2.1.Що таке гравіметричний метод аналізу?
2.2.Чим характеризується метод виділення в гравіметричному аналізі?
2.3.Чим характеризується метод відгонки в гравіметричному аналізі?
2.4.Чим характеризується метод осадження в гравіметричному аналізі?
2.5.Наведіть приклади гравіметричних визначень за методом осадження.
2.6.Як визначається маса наважки у методі осадження?
2.7.Як визначається кількість осадника у методі осадження?
2.8.Як обчислюються результати гравіметричного аналізу по методу осадження?
2.9.З яких основних стадій складається процес утворення твердої фази у розчині?
2.10.Що таке адсорбційне спів осадження?
2.11.Що таке окклюзія?
2.12.Що таке хімічне спів осадження?
2.13.Що таке ізоморфне спів осадження?
2.14.Перелічите оптимальні умови утворення кристалічних осадів.
2.15.Перелічите оптимальні умови утворення аморфних осадів.
2.3 ТИТРИМЕТРІЯ(ОБ’ЄМНИЙ АНАЛІЗ)
Титриметрія -метод кількісного хімічного аналізу, який засновано на вимірюванні об’єму розчину реактиву точно відомої концентрації, яка необхідна для взаємодії з даною кількістю речовини, що визначається. Розчин реактиву точно відомої концентрації зветься стандартним, титрованим, робочим розчином, чи титрантом. Титрування – поступове, контролюємо додавання стандартного розчину к розчину, що аналізується, до досягнення точки еквівалентності (точки кінця титрування) – моменту у якому кількості речовин, що взаємодіють, еквівалентні.
В титриметрії в залежності від типу рівноваги реакцій, виділяють:
- кислотно-основне титрування(метод нейтралізації);
- окисно-відновне титрування(оксидиметрія, редоксиметрія);
- метод осадження(седиметрія);
- метод комплексоутворення.
Реакції, що використовуються у титрометрії, повинні відповідати таким вимогам: бути стехіометричними, перебігати швидко і бажано при кімнатній температурі, перебігати кількісно (константа рівноваги 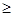 108), зайві речовини, які присутні у розчині, не повинні заважати титруванню, точка еквівалентності повинна фіксуватися тим чи іншим чином різко і точно.
108), зайві речовини, які присутні у розчині, не повинні заважати титруванню, точка еквівалентності повинна фіксуватися тим чи іншим чином різко і точно.
В титриметрії також розрізняють:
- пряме титрування, коли аналізуєма речовина безпосередньо титрується стандартним розчином;
- зворотне (титрування по залишку) титрування, коли титрується(другим стандартним розчином) та частина допоміжного(першого) стандартного розчину, який береться у надлишку, що не взаємодіяла з аналізуємою речовиною;
- титрування замісника, коли титрується(другим стандартним розчином) речовина, що утворилася при взаємодії аналізуємого розчину з першим стандартним розчином, що береться в надлишку.
Стандартні розчини готують за точною наважкою, по установчим розчинам (якщо приготувати стандартний розчин за точною наважкою неможливо) і з фіксаналів (стандарт титри, нормо дози). При приготуванні стандартних розчинів за установчими речовинами спочатку готують стандартний розчин приблизної концентрації, а точну концентрацію встановлюють за розчином установчої речовини, який готують за точною наважкою.
Для титрування збирають установку яка складається з бюретки, штативу, воронки і конічної колби. Бюретка заповнюється стандартним розчином через воронку і цей розчин по краплям додають до розчину з речовиною, що визначається, і який знаходиться у колбі для титрування, до
досягнення точки кінця титрування. Витрачений об’єм реактиву Vст.р ., який пішов на титрування до точки еквівалентності, точно фіксується і використовується для визначення вмісту речовини.
Точку кінця титрування можна визначити такими засобами:
1.По зміненню кольору розчину, якщо аналізуєма речовина, титрант чи продукти реакції забарвлені (наприклад у перманганатометрії розчин перманганату калію має червоно-малиновий колір і при титруванні зайва крапля його забарвлює розчин у світло-рожевий колір, що свідчить про досягнення точки кінця титрування).
2.За допомогою речовин, які змінюють колір при досягненні певного значення якогось параметру, що змінюється в процесі титрування (наприклад при кислотно-основному титруванні це рН розчину). Такі речовини звуться індикаторами.
3.Інструментальними методами (потенціометричним, кулонометричним, фотометричним), будуючи і аналізуючи криву титрування.
Розрахункові формули методу титриметрії (пряме титрування) базуються на законі еквівалентів – кількість моль-еквівалентів визначаємої речовини дорівнює у точці еквівалентності кількості моль-еквівалентів стандартного розчину.
Запишемо еквівалентні концентрації визначаємої речовини і стандартного розчину:
Nв.р. =
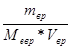 , Nст.р. =
, Nст.р. =
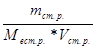 ,
,
У точці еквівалентності:
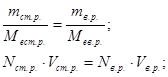
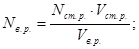
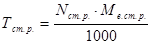 ;
;
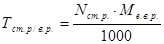 ;
;
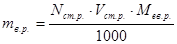 ;
; ;
;
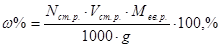 ;
;
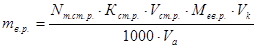
де М – молярна маса речовини, г/моль;
Ме – молярна маса еквіваленту, г/моль×екв;
N – еквівалентна концентрація, моль-екв./л;
Тст.р .- титр стандартного розчину, г/мл;
Тст.р/в.р .- титр стандартного розчину за визначаємою речовиною, гв.р./млст.р;
Vст.р .-об'єм стандартного розчину у точці еквівалентності, мл;
Vв.р . - об'єм розчину визначаємої речовини, мл;
mв.р . – кількість речовини, г;
g – наважка речовини, г;
Va – об’єм аліквотної частини;
Vk – об’єм мірної колби;
Nт.ст.р. – теоретичне значення еквівалентної концентрації стандартного розчину;
Кст.р. = Nст.р./Nт.ст.р. – коефіцієнт на поправку концентрації стандартного розчину;
w - масова частка речовини, %.
При розрахунках титри і еквівалентні концентрації визначаються з чотирма значущими цифрами.
Ці формули використовуються і при розрахунках результатів титрування замісника.
Розрахунки за методом зворотного титрування виконуються за формулою:
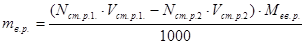 , г,
, г,
де індекс ст.р.1 – відноситься до стандартного розчину, який узятий в надлишку, а індекс ст.р.2 – до стандартного розчину, який витрачено на титрування.
В процесі титрування при додаванні титранту відбувається змінення концентрації реагуючих речовин, яке супроводжується зміненням якого-небудь параметру. В кислотно-основному титруванні це змінення рН, в окисно-відновному – змінення окисно-відновного потенціалу розчину. Змінення аналітичного сигналу можливо зобразити графічно в залежності від кількості доданого стандартного розчину.

Рисунок 2.2 – Крива титрування
Лінія, яка зображує хід змінення якої-небудь властивості розчину у процесі титрування зветься кривою титрування(рисунок 2.2). Вона дозволяє простежити змінення властивості розчину у різні моменти титрування, встановити точку еквівалентності, об’єм стандартного розчину у точці еквівалентності – Vт.е. і правильно вибрати індикатор.
При будуванні кривої титрування визначають значення параметру, що змінюється, в залежності від концентрації розчину за відповідними розрахунковими формулами, які залежать від типу реакції, яка використовується. Розрахунок концентрації розчину у різні моменти титрування виконується наступним чином.
До початку титрування концентрація розчину дорівнює початковій концентрації аналізуємого розчину.
До точки еквівалентності у розчині відсутній титрант, а присутні речовина, що визначається, і продукт її взаємодії з титрантом. З додаванням титранту кількість речовини, що визначається, зменшується еквівалентно кількості титранту і в загальному вигляді концентрація речовини, що визначається, може бути розрахована за формулою:


 ,
,
де Nв.р* – еквівалентна концентрація розчину речовини, що визначається, у даний момент, моль-екв./л;
Nв.р. – початкова еквівалентна концентрація розчину речовини, що визначається, моль-екв./л;
Nст.р. – еквівалентна концентрація стандартного розчину, моль-екв./л;
Vст.р .- об'єм доданого стандартного розчину, мл;
Vв.р . - об'єм розчину речовини, що визначається, мл;
В точці еквівалентності у розчині немає ні речовини, що визначається, ні титранту, а є лише продукти їх взаємодії.
Після точки еквівалентності у розчині будуть присутні лише титрант і продукти його взаємодії з речовиною, що визначалася, і концентрація розчину буде залежати від кількості доданого титранту - Vст.р . і кількості речовини, що визначалася:
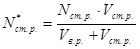 .
.
де Nст.р.* – еквівалентна концентрація речовини стандартного розчину у даний момент, моль-екв./л;
Контрольні питання до теми 2.3
3.1.Що таке титриметрія?
3.2.Який метод титрування засновано на протолітичній рівновазі?
3.3.Який метод титрування засновано на рівновагі розчин-осад?
3.4.Який метод титрування засновано на реакціях окислення-відновлення?
3.5.Який метод титрування засновано на рівновазі утворення комплексних сполук?
3.6Які вимоги до реакцій, які використовуються в титриметрії?
3.7.Установка і техніка роботи при титруванні.
3.8.При якому методу титрування титрант безпосередньо додають до розчину?
3.9.При якому методу титрування 1-ий стандартний розчин у надлишку додають до розчину аналізуємої речовини, а ту його кількість, що не прореагувала, знаходять титруючи залишок другим стандартним розчином?
3.10.При якому методу титрування 1-ий стандартний розчин у надлишку додають до розчину аналізуємої речовини, а другим стандартним розчином визначають кількість речовини, що утворилася, яка еквівалентна кількості визначаємої речовини?
3.11.Як готують стандартні розчини в титриметрії?
3.12.Якими засобами можна визначити точку кінця титрування?
3.13.На чому засновані розрахунки в титріметрії?
3.14.Що таке крива титрування? Що вона дозволяє визначити?
3.15.Як розраховується концентрація розчину у різні моменти титрування?
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 2248; Нарушение авторских прав?; Мы поможем в написании вашей работы!