
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
С методи редоксиметрії
|
|
|
|
Основи методу. Способи фіксування точки еквівалентності у редоксиметрії. Константа рівноваги, швидкість окисно-відновних реакцій, залежність від температури, рН, каталізатору. Криві титрування, інтервал переходу редокс-індикаторів та вибір індикатора за стрибком потенціалу на кривій титрування. Класифікація методів редоксиметрії.
ОКИСНО-ВІДНОВНЕ ТИТРУВАННЯ
Основи методу. У методах оксидиметрії використовуються окисно-відновні реакції, тобто реакції, які пов'язані зі зміненням ступеню окиснення реагуючих речовин і супроводжуються переходом електронів від одних елементів до інших. У загальному вигляді окисно відновну реакцію можливо визначити схемою:
mOx1 + nRed2 = mRed1 + nOx2.
Ox1 + ne = Red1, | m
Red2 – me = Ox2, |n.
де: Ox1/Red1, Ox2/ Red2 - відповідно редокс пари першого і другого елементів.
Способи фіксування точки еквівалентності у редоксиметрії. Точка еквівалентності в окисно-відновному титруванні може визначатися без індикаторним методом, за допомогою індикаторів, фізичними методами.
В перманманганатометрії можливо без індикаторне титрування, тому що іон Mn2+ - безбарвний, а іон MnO-4 – має червоно-малиновий колір. Коли увесь відновник буде відтитровано, розчин набуває помітного рожевого забарвлення від однієї зайвої краплі перманганату калію. Без індикаторів можливо титрувати і розчином йоду оскільки притаманний йому темно-бурий колір зникає при відновлені його до іонів I-. (Але при титруванні з індикатором - крохмалем, результати точніше).
Індикатори, які використовуються в окисно-відновном титруванні бувають двох видів.
1.індикатори, які вступають в специфічну реакцію з окислювачем, чи відновником. Наприклад у йодометрії використовується крохмаль, який утворює з йодом адсорбційну комплексну сполуку інтенсивно синього кольору.
2.Окислювально-відновні індикатори, які змінюють свій колір при зміненні окисно-відновного потенціалу(ОВП) системи, яка присутня у розчині. Це речовини, які спроможні оборотньо окислятися або відновлятися, причому окислена і відновлена форми мають різне забарвлення. Між ними існує рівновага, яка порушується при зміні окисно-відновного потенціалу:
IndOx+ ne-  IndRed.
IndRed.
Згідно рівняння Нернсту, окисно-відновний потенціал цієї системи:
EInd=E0Ind+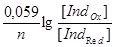 .
.
де: E0Ind - стандартний потенціал індикатору, при якому [ IndOx ] = [ IndRed ].
Перехід індикатора з однієї форми у іншу відбувається при потенціалі переходу, при якому концентрації окисної і відновної форм дорівнюють одна одній [ IndOx ] = [ IndRed ]. Інтервал переходу індикатора(зміна забарвлення розчину) знаходиться у межах, коли відповідні форми індикатору відрізняються у 10 разів.
Якщо: 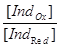 =
= , то EInd=E0Ind -
, то EInd=E0Ind - .
.
Якщо: 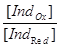 =
=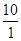 , то EInd=E0Ind +
, то EInd=E0Ind + .
.
Таким чином інтервал переходу забарвлення індикатору:
ΔEInd=E0Ind ± .
.
Прикладом окисно-відновного індикатора є дифеніламін. Стандартний потенціал дифеніламіну E0ДФА =+0,76В, інтервал переходу ΔEДФА= 0,76 ±. 0,029В у сильно кислому середовищі, [ IndOx ] – синьо-фіолетовий колір(Е>0,79В), [ IndRed ] – безбарвний (Е<0,73В).
Окисно-відновні реакції зворотні. Як було показано раніше придатність реакцій для кількісного аналізу визначається константою рівноваги, яка повинна бути Кр >108. Значення константи рівноваги дає можливість визначити напрямок і повноту перебігання реакцій. Оскільки у довідниках наведені дані по окислювально-відновним потенціалам(ОВП) редокс пар, з’ясуємо зв'язок між ними і константою рівноваги.
Розглянемо реакцію:
5Fe2+ + MnO4- + 8 H+  5Fe3+ Mn2+ + 4H2O.
5Fe3+ Mn2+ + 4H2O.
Константа рівноваги цієї реакції:
Кр =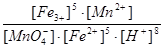 .
.
В реакції приймають участь редокс пари MnO4-/Mn2+ і Fe3+ /Fe2+. Стандартні ОВП 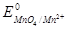 =+1,51В і
=+1,51В і 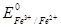 =+0,77В. Відповідні іонно-електронні напівреакції:
=+0,77В. Відповідні іонно-електронні напівреакції:
MnO4- + 8H+ + 5e = Mn2+ + 4H2O,
Fe3+ + 1e = Fe2+.
Окисно-відновні потенціали:
 =
=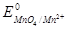 +
+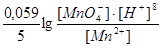 ,
,
 =
=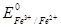 +
+ .
.
Рівновага наступить коли окисно-відновні потенціали окисника і відновника стануть рівними  =
= .
.
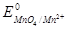 +
+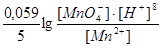 =
=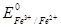 +
+ .
.
 -
-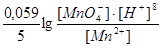 =
=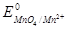 -
-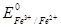 .
.
 [
[ -
- ] =
] = 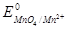 -
-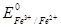
 =(
=(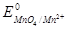 -
-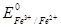 )*5/0,059=lg Kp.
)*5/0,059=lg Kp.
У загальному вигляді:
lgKp =  ,
,
де: E0Ox, E0Red - стандартні потенціали редокс пар, що виступають у даній реакції як окислювач і відновник.
З формули очевидно, що константа рівноваги повинна бути тим більшої, чим більше різниця стандартних ОВП. Якщо ця різниця велика, реакції йдуть практично до кінця. Якщо прийняти для практично необоротної реакції Kp =108, то це відповідає(для числа електронів n =1) різниці потенціалів E0Ox- E0Red = 0,059*8 0,48B. Навпаки, при малій різниці потенціалів хімічна реакція до кінця не дійде. Зауважимо, що коли стандартні ОВП окислювача і відновника близькі, змінюючи умови реакції можливо змінити і її напрямок. Такими умовами є: концентрації окислювальної і відновної форм, утворення осадів, або комплексних сполук, змінення рН розчину.
0,48B. Навпаки, при малій різниці потенціалів хімічна реакція до кінця не дійде. Зауважимо, що коли стандартні ОВП окислювача і відновника близькі, змінюючи умови реакції можливо змінити і її напрямок. Такими умовами є: концентрації окислювальної і відновної форм, утворення осадів, або комплексних сполук, змінення рН розчину.
Крім константи рівноваги велике значення має швидкість перебігання реакції для застосування її при кількісних визначеннях. На швидкість реакції впливають:
1. Температура. Чим вище температура, тим швидше перебігає реакція. Тому іноді реакцію здійснюють при 70-800С.
2. Збільшення концентрації речовини досліджуваного розчину збільшує швидкість реакції.
3.Швидкість деяких реакцій залежить від концентрації іонів гідрогену і може бути збільшена додаванням кислоти.
4. Вплив каталізаторів. Є речовини, додавання яких до реагуючої системи збільшує швидкість реакції – каталізатори. Якщо каталізатором є продукт реакції, то такі реакції звіть автокаталітичними. Наприклад в перманганатометрії перші краплі перманганату знебарвлюються вельми повільно, але потім швидкість реакції значно збільшується. Це пояснюється каталітичною дією іонів Mn2+, які накопичуються і прискорюють перебіг реакції.
Криві титрування. При оксидиметричному титруванні концентрації речовин, що реагують, увесь час змінюються, відповідно змінюється окисно-відновний потенціал розчину, який можна розрахувати. Наприклад для реакції:
5Fe2+ + MnO4- + 8 H+  5Fe3+ Mn2+ + 4H2O.
5Fe3+ Mn2+ + 4H2O.
розчин містить дві окисно-відновні пари MnO4-/Mn2+ і Fe3+ /Fe2+:
 =
=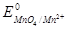 +
+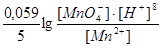 , (1)
, (1)
 =
=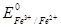 +
+ . (2)
. (2)
Для розрахунку можна використовувати будь-яке рівняння. Поки не від титровано весь ферум – то краще використовувати рівняння(2), а після точки еквівалентності – рівняння (1).
Криві титрування будують, як і в кислотно-основному методі, але в координатах окисно-відновний потенціал - Е – Vст.р. – об’єм стандартного розчину.
Якщо окисно-відновний потенціал завдавати на графіку в різноманітні моменти титрування, отримуємо криву титрування, що має вид кривої, характерної для кривих титрування при нейтралізації.
У області від 0,1% надлишку Fe2+ до 0,1% надлишку MnO4- спостерігається стрибок потенціалу від 0,9В до 1,47В. Розмір стрибка потенціалу поблизу точки еквівалентності залежить від різниці нормальних окисно-відновних потенціалів - чим більше різниця, тим більше стрибок, і не залежить (звичайно, при однакових стехіометричних коефіцієнтах) від концентрації розчинів, оскільки в рівняння Нернста входить відношення концентрацій. У точці еквівалентності:  =5
=5 = Ет.е., тому:
= Ет.е., тому:
Ет.е. +5Ет.е. = 6Ет.е. = 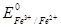 +5
+5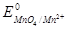 = bEOx +aERed.
= bEOx +aERed.
Ет.е. =  =
= =1,38В.
=1,38В.
де a - стехіометричний коефіцієнт окисника(число електронів, яке приймає відновник),
b - стехіометричний коефіцієнт відновника(число електронів, яке приймає окисник).
У даному випадку цей потенціал буде рівним 1,38В.
Крива титрування 100мл 0,1н розчину FeSO4 0,1 н розчином KMnO4 наведена на рис. 2.10.

Рисунок 2.10 – Крива титрування 100 мл 0,1 н розчину FeSO4 0,1 н розчином KMnO4
Класифікація методів редоксиметрії. В залежності від основного окисника чи відновника, розрізняють такі методи редоксиметрії:
1. Перманганатометрія – титрант KMnO4.
2. Йодометрія – титрант І2.
3. Дихроматометрія – титрант K2Cr2O7.
4.Церіметрія – титрант Ce(SO4)2.
5.Броматометрія – титрант KbrO3.
Контрольні питання до теми 2.6
6.1.На чому засновано метод редоксиметрії?
6.2.Які способи фіксування точки еквівалентності використовуються у редоксиметрії?
6.3.На чому засновано використання окисно-відновних індикаторів?
6.4.Як визначити інтервал переходу забарвлення індикатору?
6.5.Константа рівноваги окисно-відновної реакції. ЇЇ зв’язок з окисно-відновними потенціалами редокс пар.
6.6. Які фактори впливають на швидкість окисно-відновної реакції?
6.7.Як будується крива окисно-відновного титрування?
6.8. Як розрізняють методи редоксиметрії в залежності від основного окисника чи відновника?
|
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 3266; Нарушение авторских прав?; Мы поможем в написании вашей работы!