
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Защита металлов от коррозии
|
|
|
|
Классификация коррозионных процессов.
Коррозионные процессы классифицируют по:
1. механизму взаимодействия металлов с внешней средой;
2. по виду коррозионной среды и условиям протекания процесса;
3. по характеру коррозионных разрушений;
4. по видам дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму процесса различают химическую и электрохимическую коррозию металлов.
Химическая коррозия характерна для сред, не проводящих электрический ток (газы, жидкие неэлектролиты, например нефть, керосин, бензин т. д.). Протекает без участия направленного перемещения электронов электрического тока.
Электрохимическая коррозия характерна для сред, проводящих электрический ток. Сопровождается направленным потоком электронов и ионов. Обязательным участником коррозионного процесса является электролит.
По виду коррозионной среды и условиям протекания различают несколько видов коррозии:
Газовая коррозия - это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д.
Атмосферная коррозия — это коррозия металлов в атмосфере воздуха или любого влажного газа.
Подземная коррозия — это коррозия металлов в почвах и грунтах.
Биокоррозия — это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов.
Контактная коррозия — это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите.
Радиационная коррозия - это коррозия, обусловленная действием радиоактивного излучения.
Коррозия внешним током и коррозия блуждающим током. В первом случае — это коррозия металла, возникающая под воздействием тока от внешнего источника. Во втором случае - под воздействием блуждающего тока.
Коррозия под напряжением - коррозия, вызванная одновременным воздействием коррозионной среды и механических напряжений. Если это растягивающие напряжения, то может произойти растрескивание металла. Это очень опасный вид коррозии, особенно для конструкций, испытывающих механические нагрузки (оси, рессоры, автоклавы, паровые котлы, турбины и т.д.). Если металлические изделия подвергаются циклическим растягивающим напряжениям, то можно вызвать коррозионную усталость. Происходит понижение предела усталости металла. Такому виду коррозии подвержены рессоры автомобилей, канаты, валки прокатных станов.
Коррозионная кавитация — разрушение металла, обусловленное одновременным коррозионным и ударным воздействием внешней среды.
Фреттинг-коррозия — это коррозия, вызванная одновременно вибрацией и воздействием коррозионной среды. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
По характеру коррозионных разрушений коррозия подразделяется на сплошную и избирательную.
Коррозия называется сплошной, если она охватывает всю поверхность металла. Сплошная коррозия может быть равномерной, если процесс протекает с одинаковой скоростью по всей поверхности металла, и неравномерной когда скорость процесса неодинакова на различных участках поверхности. Равномерная коррозия наблюдается, например, при коррозии железных труб на воздухе.
При избирательной коррозии разрушается одна структурная составляющая или один компонент сплава. В качестве примеров можно привести графитизацию чугуна или обесцинкование латуней.
Местная (локальная) коррозия охватывает отдельные участки поверхности металла. Местная коррозия может быть выражена в виде отдельных пятен, не сильно углубленных в толщу металла; язв - разрушений, имеющих вид раковины, сильно углубленной в толщу металла, или точек (питтингов), глубоко проникающих в металл. Первый вид наблюдается, например, при коррозии латуни в морской воде. Язвенная коррозия отмечена у сталей в грунте, а питтинговая — у аустенитной хромоникелевой стали в морской воде.
Подповерхностная коррозия начинается на поверхности, но затем распространяется в глубине металла. Продукты коррозии оказываются сосредоточенными в полостях металла. Этот вид коррозии вызывает вспучивание и расслоение металлических изделий.
Межкристаллитная коррозия характеризуется разрушением металла по границам зерен. Она особенно опасна тем, что внешний вид металла не меняется, но он быстро теряет прочность и пластичность и легко разрушается. Связано это с образованием между зернами рыхлых малопрочных продуктов коррозии. Этому виду разрушений особенно подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы.
Щелевая коррозия вызывает разрушение металла под прокладками, в зазорах, резьбовых креплениях и т.д.
5. Химическая коррозия обусловлена взаимодействием металлов с сухими газами и жидкими неэлектролитами в условиях, когда влага на поверхности металла отсутствует, и электродные процессы на границе раздела фаз не возникают. Химическая коррозия — это процесс взаимодействия металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента среды протекают единовременно в одном акте. Продукты взаимодействия пространственно не разделены. Химическая коррозия металлов — это самопроизвольный окислительно-восстановительный процесс, подчиняющийся законам гетерогенных химических реакций, которые осуществляются одновременно в одном акте в точке взаимодействия металла с компонентом агрессивной среды. Металл в процессе химической коррозии выступает в роли восстановителя, он отдаст электроны и окисляется.
Компонент агрессивной среды выступает в роли окислителя, акцептора электронов. В процессе реакции он восстанавливается. В роли окислителей могут быть О2, Cl2, HCl, SO2, СО2 и т.д.
Пример. В промышленности синтез хлористого водорода из хлора и водорода осуществляют при 1000-1200°С. Если при этом применяют металлические печи, то внутренняя поверхность пе-чи подвержена газовой коррозии. В зависимости от содержания хлора и водорода в смеси газов протекают реакции:
Fe + Cl2 = FeCl2
или
2Fe + 3 Cl2 = 2FeCl3
Железо выступает в качестве восстановителя, хлор — окислите-ля, а на поверхности металла образуется солевая пленка.
Для большинства процессов основным условием осуществления химической коррозии является отсутствие на поверхности металла пленки воды. Это требование может быть достигнуто при соблюдении одного из трех условий:
• реагирующие газы содержат минимальное количество влаги (как правило, не более сотых долей процента);
• контакт металла и газов осуществляется при высоких температурах, превышающих «точку росы», когда конденсация влаги на поверхности металла не происходит;
• металл находится в среде неполярных органических соединений.
Химическая коррозия может быть газовой и жидкостной.
а) Газовая коррозия — окисление металла газообразными окислителями: кислородом воздуха, продуктами сгорания каменного угля, а также других видов топлива и т. д. Процесс может протекать при высокой и невысокой температурах.
Высокотемпературная коррозия имеет место при горячей обработке металлов. Так. при горячей механической (ковка, прокат) и термической (закалка, отпуск) обработке стали идет поверхностное окисление металла — образование окисидов железа FeO, Fe2О3 окалины Fe3О4. При этом пленки бывают различной толщины, сплошные и пористые. Сплошные окисидные пленки защищают металл от дальнейшего окисления или затрудняют этот процесс, пористые – обладают малыми защитными свойствами. При толщине пленки 0,4-0,5 мкм получаются так называемы «цвета побежалости».
В основе коррозионных явлений, протекающих в газовой среде при невысокой температуре, во многих случаях лежит хемосорбция атмосферного кислорода. При этом на ряде металлов образуется тончайший слой окисла. Он может состоять всего из нескольких рядов молекул и иметь толщину десятков ангстрем. Несмотря на это, такая пленка в состоянии защищать металл от дальнейшей коррозии. Тонкий сплошной слой окисла, образующийся на металле путем хемосорбции кислорода и предохраняющий металл от коррозии, называется «оксидная пленка». На поверхности таких металлов, как Ni, Сг, Си, окисная пленка очень тонка и не изменяет внешнего вида металла. Толщина подобных пленок имеет порядок 10-15 А и может быть обнаружена только при помощи специальных оптических приборов. При толщине пленок 50—100 и более ангстрем внешний вид металла изменяется - он теряет свой металлический блеск, тускнеет. Толщина окисных пленок у Mg, Al, Рb достигает 200-400 А. В этом случае металл приобретает цвет, свойственный его окислу.
Толщина окисной пленки сильно возрастает с повышением температуры. Большую роль играет и состояние поверхности. Например, полированный алюминий трудно окисляется и стойко сохраняет свой блестящий вид.
Защитные свойства окисных пленок в основном зависят от соответствия кристаллохимических структур металла и пленки. Так, безводный оксид железа Fe2О3, имеет кубическую структуру - такую же, как и у самого железа. Этот окисел в состоянии защищать металл от дальнейшей коррозии. В то же время образующаяся во влажном воздухе ржавчина представляет собой гидратированный оксид железа Fe2О3·H2О, имеющую ромбическую структуру, т. е. иную, чем железо. Таким несоответствием в кристаллических решетках ржавчины и железа и объясняется отсутствие защитных свойств у ржавчины.
Изложенное показывает, что протекание процесса коррозии в атмосферных условиях в большой степени зависит от свойств продуктов окисления металла, образующихс
при этом. Так, цинк, согласно своему положению в электрохимическом ряду, является металлом, значительно менее электронофильным, чем железо. В соответствии с этим цинк должен окисляться на воздухе легче железа, что на самом деле и имеет место. В то же время на практике железо предохраняют от ржавления при помощи цинка. Оциикованное железо в атмосферных условиях довольно стойко против коррозии. Изделия из него более долговечны, чем из неоцинкованного железа.
Причина указанного явления заключается в следующем. Окисная пленка Zn герметически прикрывает металл и изолирует его от внешних коррозионных агентов. Подобное совершенно не свойственно рыхлым хрупким слоям железной ржавчины. Более того, последняя даже способствует коррозии железа, образуя с ним гальванопару. В результате этого то или иное железное изделие с течением времени может полностью превратиться в красно-бурый порошок ржавчины
Окисные пленки обладают электроизоляционным свойствами и являются хорошей основой для лакокрасочных покрытий.
Плотную защитную окисную пленку можно искусственно получить npи невысокой температуре и на железе. Это достигается действием сильных окислителей (например, крепкой азотной кислотой). При этом, как говорят, железо пассивируется. Образующийся слой окиси металла настолько тонок, что незаметен на вид и, в противоположность обычной ржавчине, очень плотен. Этот слой защищает железо от коррозии. Пассивированное железо некоторое время даже не реагирует с разбавленной азотной кислотой, в которой этот металл в непассивированном состоянии легко растворяетется. Аналогично можно пассивировать Al, Сr, Ti, нержавеющие стали и др.
С другой стороны, если создать условия, препятствующие образования сплошных окисных пленок, то коррозия таких, например, металлов, как алюминий, будет протекать очень интенсивно. В подобном случае алюминиевая пластинка быстро покрывается рыхлой массой окиси алюминия, причем он
даже разогревается (коррозия металлов, как процесс окислительный, экзотермичен).
Вещества, способствующие в определенных условиях переходу металла в пассивное состояние, называются пассиваторами («пассивирующие» вещества). Такими являются кислород воздуха и окислители в растворах. Пассивирующим действием на железо обладает также гидроксид-ион (ОН-). Окисные пленки можно также получать окислением металла на аноде электролизной ванны (анодное окисление металла или анодирование).
Некоторые вещества препятствуют образованию стойкой пассивирующей пленке. Сюда в первую очередь относятся Сl--ионы.
б) Жидкостная коррозия — коррозия металла в жидкой среде, не проводящей ток. В таких средах, как нефть, бензин, керосин, смазочные масла обычно развивается химическая коррозия.
Однако наличие даже небольших количеств влаги в указанных вещества сообщит коррозии электрохимический характер.
Металлы могут корродировать и в результате их взаимодействия с твердыми веществами. Большую роль здесь играют влажность вещества и его химическая активность. Например, железо сильно ржавеет в соприкосновении с хлорной или гашеной известью. Процессы коррозии а подобных условиях имеют сложный характер и во многих случаях представляют coбой сочетание химической и электрохимической коррозии.
6. Электрохимическая коррозия является результатом протекания сопряженных электродных процессов и возникает при контакте металлов с электролитами (на воздухе, в почве, в растворах электролитов и т.п.). Электрохимическая коррозия - это процесс взаимодействия металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном акте и их скорости зависят от электродного потенциала.
Причиной электрохимической коррозии является возникновение на поверхности металла короткозамкнутых гальванических элементов.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Анодное растворение металла может протекать по двум различным механизмам:
а) окисление металла, являющегося анодом самопроизвольно возникающей гальванической системы. Это так называемая гальванокоррозия.
б) окисление металла, являющегося анодом своеобразной электролизной системы, самопроизвольно возникающей под влиянием тока от внешнего источника – электрокоррозия.
Очень чистые металлы практически не подвергаются коррозии. Однако, такие металлы практически не используются. Обычно металлы и сплавы, используемые в технике, содержат примеси (включения в их кристаллическую структуру), которые и являются центами развития коррозии. Неоднородности технического железа в виде микроскопически малых примесей содержит зерна углерода (уголя, графит), цементита Fe3C, шлака и другие инородные включения, не отдают электронов в поверхностный раствор, являясь электронными проводниками. Легкоподвижные электроны, распространяясь но проводникам первого рода (металл + включения), попадают и на частицы графита С, заряжая их отрицательно. На поверхности графитовых частиц катионы водорода уже не встречают препятствий в виде барьера из одноименно заряженных катион
металла и разряжаются:
2Н+ + 2е-= 2Н2.
На место связываемых таким путем электронов на графитовые включения поступают новые (за счет атомов железа). Таким образом в твердых проводниках первого рода, находящихся между собой в контакте, возникает поток электронов, направленный от железа к графиту (коррозионный электрический ток). В свою очередь поверхностно растворенные гудратированные катионы железа теперь уже не удерживаются электростатическим притяжением электронов в пограничном слое металл-жидкость, покидают этот слой, диффузно переходя в раствор. Таким путем в жидком электролите создается поток положительных зарядов, также направленный от железа к графиту. Оба потока (ионный и электронный) находятся в сопряженном состоянии: обусловливая друг друга, одинаковы по числу зарядов, но противоположны по знаку.
Мы видим, что растворение технического железа в кислоте по существу обусловливается работой своеобразных микроскопически малых гальванических цепей, где электродами являются железо (анод) и графит (катод). При этом железо анодно окисляется и переходит в раствор.
Гальванический элемент, аналогичный указанному выше, можно осуществить. взяв электроды Fe и С (графитовый стержень) раздельно и соединив их электронным проводником, например медной проволокой L. Проводник L явится внешней цепью гальванического элемента.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро-, а макрогальванопара, и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий–медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окисления ионы переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов, и работа коррозионного гальванического элемента прекратится.

Рис.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от кислотности среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере. В этом случае железо будет анодом (E 0= –0,44В), а медь – катодом (E 0=+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризации ионами водорода, которые присутствуют в электролите:
| Аn (-): | Fe – 2e-→ Fe2+ | – окисление |
| Кt (+): | 2H+ + 2e-→ H2↑ | – восстановление |
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl|Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
| Аn (-): | Fe – 2e-→ Fe2+ | – окисление |
| Кt (+): | 2H2O + O2 + 4e-→ 4 OH– | – восстановление |
Схема короткозамкнутого гальванического элемента:
А (–) Fe | H2O, O2 | Cu (+) К
У поверхности металла в электролите протекают следующие реакции:
Fe2+ + 2 OH– → Fe(OH)2
4Fe(OH)2 + O2 + 2 H2O → 4 Fe(OH)3
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода. Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).

Рис.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Применение различных методов защиты металлов от коррозии позволяет в какой-то степени свести к минимуму потери металла от коррозии. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Обработка внешней среды, в которой протекает коррозия. Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Например, для удаления из воды кислорода используют специальные вещества или кипячение. Удаление кислорода из коррозионной среды называется деаэрацией. Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов. Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
2) Защитные покрытия. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
А (–) Cr | H2O, O2 | Fe (+) К
| Аn (-): | Cr0– 2e-→ Cr2+ | – окисление |
| Кt (+): | 2H2O + O2 + 4e-→4OH– | – восстановление |
Cr2+ + 2 OH–→ Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4Cr(OH)2 + 2H2O + O2 → 4 Cr(OH)3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
Аn (–) Fe | H2O, O2 | Sn (+) Кt
| Аn (-): | Fe – 2e-→Fe2+ | – окисление |
| Кt (+): | 2H2O + O2 + 4e-→4OH– | – восстановление |
Fe2+ + 2 OH–→ Fe(OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
3) Электрохимическая защита. Различают два вида электрохимической защиты: катодная и протекторная. В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
Протекторная защита. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению (рисунок 8.3).
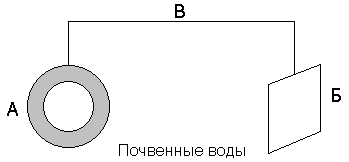
Рисунок 8.3 – Схема протекторной защиты. А – трубопровод;
Б – протектор; В – проводник
Катодная защита отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите * (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока (рисунок 8.4).

Рисунок 8.4 – Схема катодной защиты. А – конструкция; Б – протектор
Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
Во многих случаях металл предохраняет от коррозии образующаяся на его поверхности стойкая оксидная пленка (так, на поверхности алюминия образуется Al2O3, препятствующий дальнейшему окислению металла). Однако некоторые ионы, например, Cl–, разрушают такие пленки и тем самым усиливают коррозию.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1639; Нарушение авторских прав?; Мы поможем в написании вашей работы!