
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 4. Развитие учения о строении атомов
|
|
|
|
Законы
Лекция 2. Основные стехиометрические
1. Закон Авогадро — Гей-Люссака. Молекулярные массы газов.
2. Расчет атомных масс. Составление формул химических соединений.
3. Вычисление эквиваленто простых и сложных веществ.
1. Закон Авогадро – Гей-Люссака. Молекулярные массы газов
В результате исследований газов и открытия газовых законов удалось определить состав молекул простых веществ, отыскать массы молекул и атомов и, в конце концов, определить химические формулы сложных веществ. Гей-Люссак, анализируя результаты экспериментов, пришел к выводу, что объемы реагирующих и образующихся в результате реакций газов относятся между собой как небольшие целые числа. Так, исходное соотношение объемов водорода и кислорода при образовании воды составляет 2: 1, а получается 2 объёма водяного пара. Имелись данные по реакции оксида серы (IV) С кислородом, оксида углерода (II)—угарного газа с кислородом и некоторым другим газовым реакциям. Гей-Люссаком был сделан вывод; у равных объемах различных газов при одинаковых давлениях и температуре содержится одинаковое число атомов. Если в 1 объеме одного газа (водорода) и в 1 объеме другого (хлора) содержалось одинаковое количество атомов (водорода и хлора), то должен был бы образоваться 1 объем газообразного продукта реакции (хлористого водорода), а образовывалось два объема. Следовательно, сделанный вывод противоречил этим экспериментальным данным. Однако идея Гей-Люссака дала возможность Амедео Авогадро высказать (1811) гипотезу, известную сейчас как закон Авогадро.
В равных объемах различных газов, при одинаковых условиях давления и температуры содержится одинаковое число мельчайших частиц (молекул).
Казалось бы разница по сравнению с формулировкой Гей-Люссака небольшая, но эта разница принципиальная. Образование 2 объемов хлористого водорода из 1 объема водорода и 1 объема хлора привело Авогадро к мысли, что каждая из мельчайших частиц водорода и хлора состоит из 2 атомов. Аналогичные наблюдения были сделаны и в отношении реакций других простых газообразных веществ. Таким путем Авогадро пришел к заключению, что «мельчайшие частицы» большинства газообразных простых веществ при обычных условиях двухатомны, т. е. формулы простых газов Н2, Сl2, N2 и т. п. Следствия из закона Авогадро настолько важны, что всю последующую химию стали называть «авогадрова химия». Этот закон, доказательство которого приведем несколько позже, позволил не только теоретически определить понятия «атома» и «молекулы», но предоставил практическую возможность для нахождения молекулярных масс газообразных веществ, а затем и масс атомов входящих в них элементов.
Молекулярная масса вещества—средняя масса его молекулы, выраженная в углеродных единицах.
Атомная масса элемента—средняя масса природной смеси его атомов, выраженная в углеродных единицах.
Закон Авогадро позволил определять молекулярные массы газообразных веществ по их относительной плотности Dотн равной отношению масс т1 и т2 одинаковых объемов (например, 1 л) газов, взятых при одних и тех же давлении и температуре. Это отношение показывает, во сколько раз один газ тяжелее другого. Так как в равных объемах различных газов при равных условиях содержится одинаковое число молекул N, то m1=M1N и m2=M2N и тогда Dотн равна отношению молекулярной массы одного газа М1 к молекулярной массе М2 другого:
Dотн = 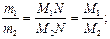 М1 = Dотн М2
М1 = Dотн М2
Обычно относительную плотность определяют либо по водороду D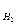 либо по воздуху Dвозд. Молекулярная масса двухатомной молекулы водорода равна двум, точнее 2,016 у. е. Относительная плотность воздуха по водороду равна 14,5. Отсюда молекулярная масса воздуха равна 29 у. е. Экспериментально определяя относительную плотность любого газообразного вещества по воздуху, легко вычислить молекулярную массу исследуемого газа:
либо по воздуху Dвозд. Молекулярная масса двухатомной молекулы водорода равна двум, точнее 2,016 у. е. Относительная плотность воздуха по водороду равна 14,5. Отсюда молекулярная масса воздуха равна 29 у. е. Экспериментально определяя относительную плотность любого газообразного вещества по воздуху, легко вычислить молекулярную массу исследуемого газа:
Мх = 29Dвозд или Мх = 2,016 D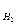
Для практического пользования введены понятия грамм-молекула (моль) и грамм-атом (моль атомов). Количество вещества № граммах, численно равное его молекулярной массе, называют молем или грамм-молекулой.
Количество вещества в граммах, численно равное атомной массе элемента, называют моль атомом или грамм-атомом элемента. Так как равные объемы различных газов содержат при одинаковых условиях одно и то же число молекул, то моли различных газов будут занимать одинаковый объем. Если задаться конкретными условиями, то объем молекул любого газа становится не только одинаков, но и строго определен. В качестве условий для сравнения приняты нормальные условия (н. у.): давление 1,01 · 105 Па (760 мм рт. ст.) и температура 0° С (273,18 К). При этих условиях моль любого газа занимает объем, равный 22,414 л.
Пример 1. При н.у. масса 1 л водорода равна m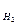 = 0,09 г. Воздуха mвозд=1,29 г. У этих газов моли равны соответственно 2,016 и 29 г.
= 0,09 г. Воздуха mвозд=1,29 г. У этих газов моли равны соответственно 2,016 и 29 г.
Решение. Объем моля газа равен:
V = 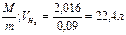 и Vвозд =
и Vвозд = 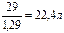
Молекулярную массу любого газа легко определить экспериментально, благодаря уравнению Менделеева—Клапейрона, вытекающему из объединенного закона Бойля — Мариотта и Гей-Люс-сака:
PV / Т = const
Если Р и Т взять для нормальных условий, а V—объем 1 моль газа при н. у. (т. е. 22,414 л), то соотношение PV/T становится величиной постоянной для любого газа. Эта величина для 1 моль обозначается R и получается уравнение Менделеева — Клапейрона для 1 моль РV = РТ или для n молей
PV = nRT
Константа R называется универсальной газовой постоянной. Физический смысл R: работа расширения 1 моля любого газа при нагревании на 1°. Численное ее значение определяется системой единиц. Наиболее употребительные значения таковы: 0,082 лХ Хатм/(моль · К), 62 360 мл · мм рт.ст./ (моль · К), 8,3146 Дж/(моль Х
Х К).
Число молей n равно отношению экспериментально определяемого количества вещества к его молекулярной массе n=m/M. Зная массу любого объема газа при какой-то конкретной температуре и давлении, можно определить его молекулярную массу:
PV = (m/M) RT, M = mRT / PV
Пример 2. Опытным путем найдено, что 304 мл газа при 25°С, или 298 К, 745мм рт.ст. весят 0,78 г. Определить молекулярную массу газа.
Решение. Для удобства выбираем R = 62 360 мл · мм рт.ст. / (моль · К):
М = mRT / PV = 0,78 · 62 360 · 298 / 745 · 304 = 64 у. е.
Если этот газ простое вещество, следовательно, его молекула двухатомна, а атомная масса равна 32 у.е.
Моль любого вещества (и соответственно моль атомов) содержит одно и то же число частиц. Это одна из важнейших физико-химических констант, названная в честь великого физика постоянной Авогадро NА == 6,02252 • 1023 моль-1. Зная величину моля и na входящих и него частиц, можно найти массу одной частицы-молекулы. В рассмотренном выше примере 1 моль, т. е. все 6,02 ·1023 молекул весят 64 г, а 1 молекула имеет массу
64 / (6,02 · 1023) =1,06 · 10-23 г.
Если молекула из двух атомов,то каждому из них соответствует масса, равная 0,53 · 10-23 г.
2. Расчет атомных масс. Составление формул химических соединений
Закон Авогадро позволил определить массы молекул и атомов только для простых газообразных веществ. Однако на его основе Станислао Канниццаро создал метод расчета атомных масс элементов, которые сами не являются газообразными, но образуют несколько летучих соединений. Идея метода проста: в молекуле не может быть менее одного атома. Следовательно, атомная масса элемента равна наименьшей его доле в различных соединениях.
По относительной плотности определяли молекулярные массы нескольких соединений одного и того же элемента. Затем путем анализа узнавали процентное содержание этого элемента в том или ином веществе. Отыскивали долю элемента — количество граммов его в 1 моле каждого вещества и минимальную величину из всех полученных принимали за атомную массу.
Пример 1. Требуется определить атомную массу углерода из следующих данных:
| Соединение | Метан | Эфир | Винный спирт | Углекислый газ |
| М Содержание С,% Содержание С, г/моль | 75,0 | 64,9 | 52,2 | 27,3 |
Из данных видно, что минимальное число частей от молекулярной массы ля углерода в соединениях 12. Этой доле кратны те, что приходятся на углерод других соединениях. Следовательно, атомная масса углерода равна 12. Точно таким же методом были найдены атомные массы фосфора, серы, хлора и других элементов, способных образовывать несколько газообразных или летучих сочинений.
Пример 2. Вычислить атомную массу фосфора на основании следующих данных:
| Вещество | Dвозд | М | Содержание Р, % |
| Хлорид фосфора Фосфористый ангидрид Фосфорный ангидрид Фосфористый водород | 4,741 3,792 4,895 1,172 | 137,48 109,96 141,96 33,98 | 22,6 56,3 43,65 |
Решение. Вычислим количество массовых частей фосфора в соединениях, округляя получающиеся значения до целого числа.
| 22,6% | от | 137,48 | составляют | мас. | ч. | |
| 56,3% | ,, | 109,96 | ,, | ,, | ,, | |
| 43,65% | ,, | 141,96 | ,, | ,, | ,, | |
| 91% | ,, | 33,98 | ,, | ,, | ,, |
Наименьшее число массовых частей будет соответствовать атомной массе фосфора А = 31.
Рассматриваемый метод пригоден только для элементов, образующих газообразные соединения. Им нельзя пользоваться для определения атомной массы элементов, у которых газообразные соединения отсутствуют или их число невелико. Для них, очевидно, необходим принципиально иной метод определения атомной массы. Одна из возможностей определения для твердого вещества массы 81 атома элемента связана с увеличением энергии атома при нагревании твердого тела. Так как число атомов в моле атомов вещества всегда равно постоянной Авогадро, то для повышения температуры 1 моль атомов вещества на 1° требуется примерно одно и то же количество теплоты. Это впервые чисто эмпирическим путем было установлено в 1819 г. французскими исследователями Дюлон-гом и Пти. Произведение удельной теплоемкости Суд твердого простого вещества на атомную массу А для большинства элементов равно 6,3. Иначе говоря, произведение
СудА = 6,3
представляет количество теплоты, необходимой/для нагревания 1 моль атомов на 1°. Для большинства элементов в твердом состоянии правило Дюлонга и Пти оказывается справедливым при комнатной температуре. Поэтому зависимость использовалась для определения атомной массы элементов, находящихся при обычных условиях в твердом состоянии.
Таким образом, цепочка рассуждений начинается от закона Аво-гадро. При помощи его получена формула, связывающая относительную плотность и молекулярную массу. Зная молекулярную массу, по методу Канниццаро или Дюлонга — Пти находим атомную массу. И, наконец, используя атомные и молекулярные массы или эквиваленты, можно вывести формулы соединений.
Пример 3. Плотность химического вещества по водороду D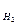 = 15. При анализе получено 80% С и 20% Н. Установить формулу соединения.
= 15. При анализе получено 80% С и 20% Н. Установить формулу соединения.
Решение. 1) атомная масса углерода 12, водорода 1. Допустим, что вещество содержит в моле х атомов углерода и у атомов водорода; 2) составляем пропорцию
12х: у = 80:20 или
х: у = 80 / 20: 20 / 1 = 6,7: 20 ≈ 1: 3.
Этому соотношению соответствует группа СН3;
3) молекулярная масса составляет
МХ = 2D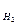 = 30.
= 30.
Следовательно, формула вещества С2Н6 – этан.
Пример 4. При анализе газообразного вещества определено что его плотность по водороду D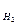 = 15,95, а состав 87,5% азота и 12,5% водорода. Определить простейшую и истинную формулы этого вещества.
= 15,95, а состав 87,5% азота и 12,5% водорода. Определить простейшую и истинную формулы этого вещества.
Решение. Определим молекулярную массу вещества
Mx = 2,026D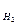 = 32,15 у.е.
= 32,15 у.е.
Соотношение азота и водорода в веществе
87,5 / 14: 12,5 / 1 = 6,25: 12,5 = 1: 2.
Простейшая формула NН2.
Найдем истинную формулу:
а) количество азота в веществе
32,15 у. е. составляют 100% вещества
х у.е.,, 87,5%,, х = 28,13 у.е.
Количество атомов азота 28,13: 14 = 2,01 ≈ 2;
б) количество водорода в веществе
32,15 у.е. – 100%
у у.е. – 12,5% у = 4,02 у.е.
Число «томов водорода 4,02: 1,008 = 3,99 ≈ 4. Истинная формула N2H4.
Пример 5. Анализом определено содержание в веществе 87,44% Si и 12,56% Н, а плотность по воздуху Dвозд = 1,108. Определить, что это за вещество и составить его формулу.
Решение: Молекулярная масса вещества
Мх = 29Dвозд = 32,13 у. е.
Количество кремния в веществе
32,13 у. е. составляют 100%
х у.е.» 87,44% х = 28,09
Количество атомов кремния
28,09: 28,08 ≈ 1.
Количество водорода
32,13 у. е. составляют 100%
у у. е.» 12,56% у = 4,03
Количество атомов водорода
4,03: 1,008 ≈ 4.
Формула вещества SiH4.
3. Вычисление эквиваленто простых и сложных веществ
Закон эквивалентов гласит: если массы двух элементов реагируют без остатка с одной и той же массой третьего элемента, то они могут без остатка реагировать и между собой.
Эквивалентом элемента называют количество вещества в молях, которое соединяется с молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в молекула.х НС1 и NaCl 1 моль атомов водорода (1,0079г) эквивалентен 1 моль атомов натрия (22,9897 г).
Эквивалентной массой Э называют массу одного эквивалента вещества, выраженную в граммах (или килограммах) на моль. Например, эквивалентная масса кислорода составляет 8 г/моль.
Эквивалентная масса элемента равна молярной массе атомов элемента, деленной на его валентность в данном химическом соединении.
Пример 1. Вычислите эквивалентную массу серы (5§) всоединении, содержащем 5,92 % водорода и 94,08 % серы.
Решение. Составим пропорцию:
5,92 г водорода приходятся на 94,08 г серы
1 г/моль »»» Э г/моль» ЭS = 16 г/моль
Пример 2. Вычислите валентность углерода в соединения, содержащем 42,85% углерода и 57,15% кислорода.
Решение. Составим пропорцию:
42,85 г углерода приходятся на 57,15 г кислорода
Э г/моль »»» 8 г/моль» ЭС = 6 г/моль
Валентность углерода в этом соединении равна 2: молярную массу (12 г/моль) делим на эквивалентную массу (6 г/моль).
Эквивалентная масса кислоты равна частному от деления ее молярной массы на основность кислоты.
Эквивалентная масса гидроксида равна частному от деления его молярной массы на валентность металла.
Эквивалентная масса соли равна частному от деления ее молярной массы на произведение числа ионов металла и его валентности.
Пример 3. Определите эквивалентные массы следующих соединений: Н3РО4, H2SО4, Са(ОН)2, А12(SО4)3, Na2CO3,
Решение. Э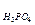 = 98/3 = 32,7 г/моль; Э
= 98/3 = 32,7 г/моль; Э = 98/2 = 49 г/моль; Э
= 98/2 = 49 г/моль; Э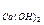 = 74/2 = 37 г/моль; Э
= 74/2 = 37 г/моль; Э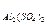 342/6 = 57 г/моль; Э
342/6 = 57 г/моль; Э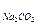 = 106/2 = 53 г/моль.
= 106/2 = 53 г/моль.
Лекция 3. Важнейшие классы и номенлатура неорганических соединений
1. Оксиды.
2. Кислоты.
3. Основания. Амфотерные гидроксиды.
4. Соли.
Неорганические соединения делят на следующие классы: оксиды, гидроксиды (кислоты и основания), амфотерные гидроксиды, соли.
1. Оксиды
По международной номенклатуре соединения элементов с кислородом называют оксидами; при обозначении этих соединений рядом с формулой или названием указывают в скобках степень окисления элемента, например FeO—оксид железа (II), Fе2О3 – оксид железа (III). Оксиды разделяют на солеобразующие и несолеобраэующие. Солеобразующие, в свою очередь делят на кислотные, основные и амфотерные.
Кислотными (SO2, CO2 и др.) называют такие оксиды, которые образуют соли с основаниями или основными оксидами, например:
SO2 + 2NaOH = Na2SO3 + Н2О
Основными (CuO, FeO и др.) называют такие оксиды, которые образуют соли с кислотами или кислотными оксидами, например:
CuO + H2SO4 = CuSO4 + Н2О
Амфотерными называют оксиды металлов, образующие соли при взаимодействии как с кислотами (кислотными оксидами), так и с основаниями (основными оксидами), например:
ZnO + 2НС1 = ZnCI2 + Н2О
ZnO + 2NaOH = Na2ZnO2 + Н2О
Основные оксиды реагируют с кислотами и кислотными оксидами:
FeO + H2SO4 = FeSO4 + Н2О; MgO + SO3 = MgSO4
Оксиды щелочных и щелочноземельных металлов вступают во взаимодействие с водой:
СаО + Н2O = Са(ОН)2
Кислотные оксиды реагируют с гидроксидами, основными оксидами и (многие) с водой:
SO2 + 2NaOH = Na2SO3 + H2O; Р2О5 + ЗСаО = Cа3(РO4)2;
SO3 + H2O = H2SO4
Способы получения оксидов:
взаимодействие веществ с кислородом
2Mg + О2 = 2MgO: S + О2 = SO2
разложение гидроксидов, кислот
Сu(ОН2) = СuО + Н2О; 2Н3ВО3 = В2О3 + 3H2O
разложение солей
СаСО3 = СаО + СО2
разложение оксидов
4СгО3 = 2Сг2О3 + ЗО2
взаимодействие кислот, обладающих окислительными свойствами, с металлами и неметаллами
С + 2H2SO4 (конц.) = СО2 + 2SO2 + 2Н2О
2. Кислоты
Число атомов водорода, способных замещаться металлами с образованием солей, определяет основность кислоты. Различают кислоты одноосновные (например НС1, НNO3), двухосновные (H2SO4, Н2S), трехосновные (Н3РO4).
По химическому составу кислоты делят на бескислородные (HF, НС1 и др.) и кислородсодержащие (Н2SО4, HNO3 и др.).
Большинство кислотных оксидов образует кислоты путем непосредственного присоединения воды. Кислотные оксиды называют ангидридами кислот. Молекулы некоторых ангидридов могут присоединять разные количества молекул воды. При этом образуются метакислоты, содержащие наименьшее количество воды, и ортокислоты, содержащие наибольшее количество воды.
Например:
Р2О5 + H2O = 2НРО3 — метафосфорная кислота
Р2О5 + 2Н2О = Н4Р2O7 — пирофосфорная кислота
Р2О5 + 3Н2О = 2Н3РO4 — ортофосфорная кислота
Название киcлот, в которых степень окисления центрального атома соответствует номеру группы в 1 таблице Д. И. Менделеева, образуется от русского (названия элемента с суффиксом «н» или «ов», например: HNO3 – азотная кислота, H2WO4 – вольфрамовая кислота.
Если элемент имеет разные степени окисления и образует не одну кислоту, то в название кислоты с низшей степенью окисления элемента вводится суффикс «ист», например: Н2SО3 – сернистая кислота; HNO2 – азотистая кислота.
Кислоты взаимодействуют с гидроксидами, основными оксидами, солями, металлами:
НС1 + NaOH = NaCI + Н2О; H2SO4 + CuO = CuSO4 + Н2О
H2SO4 + 2NaCl = Na2SO4 + 2HC1; 2HC1 + Zn = ZnCI2 + H2↑
Некоторые кислоты разлагаются:
Н2СО3 = CO2↑ + Н2О
Определяют кислоты с помощью индикаторов: лакмуса, метилового оранжевого и др.
Способы получения кислот:
взаимодействие ангидридов, с водой
N2O5 + Н2О = 2НNО3
взаимодействие солей с кислотами
NaCI + H2SO4 = NaHSO4 + НС1
окисление простых веществ
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO
соединение неметалла с водородом с последующим растворением полученного соединения в воде (получение бескислородных кислот)
Н2 + Сl2 = НС1
3. Основания. Амфотерные гидроксиды.
В зависимости от числа гидроксильных групп основания бывают однокислотные (КОН, NaOH и др.) и многокислотные [Са(ОН)2, Ва(ОН)2 и др.]. Основания, растворимые в воде, называют щелочами. К ним относят основания, образованные щелочными и щелочноземельными металлами, и гидроксид аммония.
По международной номенклатуре основания называют гидроксидами. Например, Fe(OH)2 – гидроксид железа (II), Fе(ОН)3 – гидроксид железа (III).
Амфотерные гидроксиды. Гидраты амфотерных оксидов, как и. сами оксиды, обладают амфотерными свойствами. С кислотами они взаимодействуют как основания
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Основаниями – как кислоты:
H2ZnO2 + 2NaOH = Na2ZnO2 + 2H2O
Гидроксиды реагируют с кислотными оксидами, с кислотами, с солями, некоторые при нагревании разлагаются:
Са(ОН)2 + СО2 = СаСО3↓ + H2O; NaOH + НС1 = NaCI + Н2О 2КОН + CuSO4 == Cu(OH)2↓ + K2SO4;
2Fе(ОН)3 = Fе2О3 + ЗН2О
Растворимые гидроксиды — щелочи определяют с помощью индикаторов: лакмуса, фенолфталеина, метилового оранжевого и др.
Гидроксиды получают взаимодействием:
щелочных и щелочноземельных металлов с водой
2Na + 2Н2О = 2NaOH + H2↑
оксидов щелочных и щелочноземельных металлов с водой
ВаО + Н2О = Ва(ОН)2
солей со щелочами (способ получения нерастворимых гидроксидов)
FeSO4 + 2NaOH = Na2SO4 + Fe(OH)2↓
Щелочи также получают электролизом растворов солей калия, натрия.
4. Соли
Соли делят на средние (например, Na2SO4, Nа2СО3), кислые (NaHSO4, NaHC03) и основные (NiOHNO3,A1OHSO4).
По международной номенклатуре название средних и кислых солей производят от названия кислот и металлов, их образовавших. Так: CuSO4 – сульфат меди, К2SO3 – сульфит калия, NaHSO3 – гидросульфит натрия, Nа3РO4 – фосфат натрия, NaHPO4 – гидрофосфат натрия, NaH2PO4 – дигидрофосфат натрия.
Основные соли называют гидроксосоляма, например: NiOHNO3 – нитрат гидроксоникеля, A1OHSO4 – сульфат гидроксоалюминия.
Соли реагируют с солями, кислотами, щелочами, водой, некоторые разлагаются при нагревании:
NaCI + AgNO3 = NaNO3 + AgCl↓;
СаСО3 + 2HC1 = CaCI2 + CO2↑ + Н2О
NiSO4 + 2NaOH == Na2SO4 + Ni(OH)2↓;
CuSO4 + 5H2O = CuSO4 • 5Н2О
MgCO3 = MgO + CO2↑
Средние соли получают взаимодействием:
металла с кислотой
Zn + H2SO4 (разб.) = ZnSO4 + H2↑;
Сu + 2Н2SO4(конц.) = CuSO4 + SO2↑ + 2Н2О
основного оксида с кислотой
СаО + 2HC1 = CaCI2 + Н2О
гидроксида с кислотой
2NaOH + H2SO4 = Na2SO4 + 2Н2О
соли с кислотой
СаСО3 + 2НNО3 = Сa(NО3)2 + CO2↑ + Н2О
основного оксида с кислотным
СаO + SiO2 = CaSiO3
гидроксида с кислотным оксидом
2КОН + N2O5 = 2КNО3 + Н2О
соли со щелочью
Fe(NO3)3 + 3NaOH == 3NaNO3 + Fe(OH)3↓
соли с солью
Ва(NО3)2 + Na2SO4 = BaSO4↓ + 2NaNO3
металла с солью
Fe + CuSO4 = FeSO4 + Cu↓
металла с неметаллом
Fe + S = FeS
металла со щелочью
Zn + 2NaOH = Na2ZnO2 + H2↑
неметалла со щелочью
Сl2 + 2КОН = КС1 + КС1O + Н20
неметалла с солью
Сl2 + 2KI = 2КС1 + I2
Средние соли можно получить также разложением кислородных солей при нагревании:
2КС1O3 = 2КC1 + 3O2↑
Способы получения кислых солей:
неполная нейтрализация кислоты или кислотного оксида гидроксидом
H2SO4 + NaOH = NaHSO4 + Н2О; CO2 + NaOH == NaHCO3
действие кислоты или кислотного оксида на нормальную соль той же кислоты:
Nа2SO4 + H2SO4 = 2NaHSO4;
СаСО2 + Н2О = Са(НСО3)2
Основные соли чаще всего получают неполной нейтрализацией гидроксида кислотой:
Mg(OH)2 + НС1 = MgOHCl + H2O
Кислые соли можно перевести в средние прибавлением щелочи, а основные в средние—добавлением кислоты:
NaHCO3 + NaOH = Na2CO3 + H2O;
Fe(OH)2Cl + 2НС1 = FeCI3 + 2Н2O
1. Основные положения современной теории о строении атомов.
2. Явление радиоактивности.
1. Основные положения современной теории о строении атомов
Доминирующей современной теорией электронов и других микрообъектов, обладающих очень малой массой, является квантовая механика. Оказалось, что законы движения микрообъектов принципиально отличаются от таковых для макрообъектов, к числу которых относятся все предметы, видимые в оптический микроскоп и невооруженным глазом. Квантовая механика изучает движение микрообъектов в микрополях атомов, молекул и кристаллов. Из этого определения становятся очевидными роль и значение квантовой механики для современной химии. Не будет преувеличением сказать, что она синтезировала воедино наиболее актуальные проблемы физики и химии.
Главной особенностью квантовой механики является ее вероятностный статистический характер: она дает возможность на ходить вероятность того или иного значения некоторой физической величины. Объясняется это волново-корпускулярным дуализмом микромира, т. е. микрообъекты обладают как корпускулярными, так и волновыми свойствами.
Не представляет труда обосновать объективность волново-корпускулярного дуализма для световых квантов – фотонов. Так, фотоэффект Столетова и эффект Комптона доказывают корпускулярную природу видимых и рентгеновских лучей, а их интерференция и дифракция — волновую природу света. Потому для фотонов легко по казать единство волны и корпускулы. Действительно, из формул следует Е = с2m = hν, откуда с учётом ν = с/λ получаем
с2m = h (с/λ)
или
λ = h / mc = h/р,
где λ — длина волны; р — количество движения или импульс фотона.
В 1924 г. французский ученый де Бройль высказал идею, что волново-корпускулярный дуализм присущ не только фотонам, но и всем микрообъектам. Поэтому, по де Бройлю, их движение связано с распространением волны, т. е. движение микрообъекта можно рассматривать как волновой процесс, при котором справедливо соотношение
Λ = h/ m0υ
аналогичное для фотона. Формула связывает важнейшую характеристику вещественной формы существования матери (количество движения m0υ) с характеристикой материального пол (длина волны λ) через постоянную Планка. Это и есть волново-корпускулярный дуализм.
Волновые свойства электронов, а вместе с ними идея де Бройля нашли экспериментальное подтверждение в опытах по рассеянию дифракции электронов, проведенных в 1927 г. в США, Великобритании и СССР. В Советском Союзе блестящие опыты по дифракции электронов были проведены в Ленинградском политехническом институте проф. Тартаковским П.С. Впоследствии опытным путем была обнаружена дифракция нейтронов, протонов, атоме гелия, молекул водорода других микрообъектов. В настоящее время волновые свойства материальных частиц широко применяются в методах исследования строения вещества — электронографии нейтронографии и др.
Однако идея де Бройля послужила только началом создания квантовой механики. Она рассматривала поведение микрообъекта, свободного от силового поля. В действительности же материальные частицы, например электроны, всегда находятся в поле действия определенных сил. С этой точки зрения электроны в атоме движутся в центрально- симметричном поле, для которого потенциальная энергия зависит только от расстояния до ядра. Законы движения в поле центральных сил образуют основу атомной механики: решение общей задачи о движении электронов в атоме опирается на результаты, относящиеся к движению одной частицы в поле центральных сил.
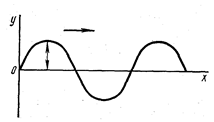
Рисунок 1. Распространение волны вдоль оси Х
На основе гипотезы де Бройля австрийский ученый Шрёдингер (1925—1926) интуитивно использовал волновое уравнение классической механики в качестве модели для описания поведения электрона в атоме. Из учения о колебаниях и волнах известно, что распространение волны вдоль координатной оси х (рисунок) описывается дифференциальным уравнением в частных производных второго порядка
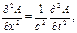
где А — амплитуда волны; с — скорость перемещения волны; t —время перемещения волны.
Но по Шрёдингеру, атомная система замкнутая, а потому поведение электрона, его движение подобно стоячей волне (рисунок). А математическое уравнение, описывающее стоячую волну, значительно проще, так как не содержит скорости и времени. Только атомная система в отличие от стоячей волны является трехмерной, а потому в уравнение для описания атомной стоячей волны Шрёдингер вводит все три аргумента: координаты х, у и z:
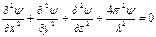
где ψ —трехмерный аналог величины А.

Рисунок 2. Стоячая волна
Теперь в выражение вместо λ подставим значение длины волны де Бройля, тогда получим
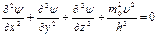
Полная энергия системы Е равна сумме потенциальной энергии U и кинетической (m0υ2/2), т. е.
Е = U + (m0υ2/2),
откуда υ2 = 2 (Е - U) /m0. Подставив это значение υ2, получим
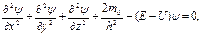
или, введя оператор Лапласа* 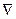 2 (набла в квадрате), запишем
2 (набла в квадрате), запишем

где
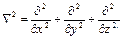
Выражение, а также есть волновое уравнение Шрёдингера для стационарного состояния, когда энергия системы не зависит от времени. В большинстве случаев задачи сводятся именно к нахождению стационарных состояний. Уравнения и не выводятся из более общих законов, а являются следствием эмпирического выбора уравнения стоячей волны в качестве модели для описания поведения электрона в атоме с учетом волны де Бройля. Правомерность такого вывода уравнения Шрёдингера доказывается тем, что его решение приводит к значениям энергии Е, точно соответствующим опытным данным из атомных спектров.
Функция ψ в уравнении Шрёдингера называется волновой функцией. Физический смысл имеет величина ψ2dυ*, равная вероятности нахождения электрона в элементарном объеме dυ = dxdydz. Таким образом, квантовая механика дает лишь вероятность нахождения электрона в том или ином месте атомной системы. Поэтому такие понятия, как траектория частицы (например, электронная орбита), в квантовой механике не имеют смысла.
В соответствии с физическим смыслом ψ2 сама волновая функция должна удовлетворять определенным условиям, которые называются стандартными условиями. Согласно последним волновая функция должна быть: 1) непрерывной, так как состояние квантовой системы в пространстве меняется непрерывно; 2) конечной, т. е. она не должна обращаться в бесконечность ни при каких значениях аргументов;
3) однозначной, ибо по смыслу ψ есть амплитуда вероятности, а потому для любой данной точки она может иметь только одно значение; 4) обращаться в нуль на бесконечности. Так, при рассмотрении поведения электрона в атоме ψ должна быть равной нулю на бесконечно большом расстоянии от ядра.
2. Явление радиоактивности
Явление радиоактивности было открыто в 1896 г. известным французским физиком Анри Беккерелем. Беккерель установил, что металлический уран, а также его минералы и соединения испускают невидимое излучение. Воздух по соседству е препаратами становится хорошим проводником электричества и разряжает электроскоп. Излучение вызывало почернение фотографической пластинки, завернутой в черную бумагу или закрытой непрозрачными предметами. Излучательная способность не зависела от температуры урансодержащего препарата, от его агрегатного состояния, а определялась только содержанием урана. Беккерель из этих наблюдений сделал заключение, что способность к излучению является свойством атомов урана и не зависит от того, входит ли уран в состав соединения.
Вскоре было обнаружено, что излучательной способностью обладает и торий, а в 1898 г. супругами Марией и Пьером Кюри были открыты два новых химических элемента — радий и полоний. Излучательная активность радия вместе с элементами, образующимися и» него, оказалась в миллион раз больше активности урана. Мария Кюри предложила термин радиоактивность для обозначения способности элементов к самопроизвольному излучению. В последующие годы были открыты еще некоторые радиоактивные элементы — актиний, эманации радия, тория и актиния (названные радоном, тороном, актиноном) и многие другие. При этом каждое из выделенных радиоактивных простых тел рассматривалось как самостоятельный химический элемент. Количество подобных «элементов» превосходило число клеток в Периодической системе и некоторые из них обладали тождественными химическими свойствами с уже известными. Введение понятия изотопа уменьшило их число. Оказалось, что радон, торон, актинон являются разными изотопами одного и того же элемента. Поэтому они должны занимать одну клетку в Периодической системе. В дальнейшем изотопия стала важнейшим свойством для большинства химических элементов.
В 1913 г. Фаянс и Содди независимо друг от друга формулируют правила радиоактивного смещения:
1. При α-распаде возникает изотоп элемента, смещенного на две клетки от исходного к началу Периодической системы и имеющий на 4 единицы меньше массовое число.
2. β-Распад приводит к возникновению изотопа элемента, смещенного на одну клетку от исходного к концу Периодической системы с тем же массовым числом. Эти правила в еще большей степени способствовали правильной расстановке радиоактивных элементов в Периодической системе и пониманию их химического поведения.
В том же 1913 г. Мозли дает в руки исследователей рентгеноспектральный метод определения положительного заряда ядра элемента, а следовательно, его места в Периодической системе. Это способствовало поиску новых радиоактивных элементов и исправлению численных значений порядковых номеров элементов. Была установлена правильная последовательность превращений одних радиоактивных изотопов в другие, открыты пропущенные звенья в цепи генетически связанных элементов — радиоактивных рядах.
В это время радиохимия как наука о химических и физико-химических свойствах радиоактивных элементов разрабатывает свои специфические методы исследования. В ее задачу входит широкий круг вопросов, связанных с проблемами разделения, очистки, концентрирования радиоактивных элементов.
Таким образом, открытие явления радиоактивности было важной вехой на пути познания окружающего мира. Изучение же радиоактивности дало неопровержимые доказательства сложности структуры атома. Оно стало основным фактом, опровергающим представления о неизменности атомов, и показало, что в определенных условиях одни атомы разрушаются, превращаясь в другие.
В 1919 г. Резерфорд впервые осуществил искусственное превращение элементов. Под действием α-частиц азот был превращен в кислород. В дальнейшем процессы взаимодействия ядер одних элементов с ядрами других (или с элементарными частицами), при которых образовывались ядра новых элементов, стали называть ядерными реакциями. Чаще всего ядерные реакции представляют собой процессы взаимодействия ядер с частицами сравнительно небольшой массы (α-частицами, протонами, нейтронами, дейтеронами и т. д.). Обозначения, которые применяются при записи ядерных реакций, аналогичны обозначениям, принятым при написании уравнений химических реакций. Символы ядер элементов, вступающих в реакцию, записываются слева, а образующихся продуктов — справа. Над символом слева вверху указывается массовое число изотопа, а слева внизу его порядковый номер. Сумма верхних индексов с левой стороны равенства должна равняться их сумме справа. Это требование относится и к сумме нижних индексов. Реакция первого искусственно вызванного ядерного превращения, осуществленного Резерфордом, записывается так:

Нередко используется более короткая запись: символы легких частиц (бомбардирующих и образующихся), записывают в скобках между символами исходного и конечного ядер. Тогда уравнение приведенной реакции запишется: 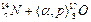 .
.
В ядерных процессах энергию относят к превращению одного ядра и выражают в электронвольтах. Энергетический эффект ядерных процессов неизмеримо больше тепловых эффектов обычных химических реакций. Так, например, реакция 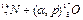 имеет Δ Н = - 1,19МэВ, или —2,74 · 1010 кал/г-атом. Эта величина по крайней мере в 100 000 раз больше самых высоких значений тепловых эффектов химических реакций.
имеет Δ Н = - 1,19МэВ, или —2,74 · 1010 кал/г-атом. Эта величина по крайней мере в 100 000 раз больше самых высоких значений тепловых эффектов химических реакций.
Ядерные реакции могут идти как с выделением, так и с поглощением энергии. Одним из наиболее известных примеров экзотермического ядерного превращения является реакция деления урана, сопровождающаяся выделением 180 МэВ. Для других ядерных процессов энергетические эффекты не столь значительны. Кроме того, надо иметь в виду, что ядерные реакции по сравнению с химическими представляют собой очень редкое событие. По-видимому, одной из причин этого является малый размер ядер, что делает маловероятными эффективные ядерные соударения. Установлено, что скорость радиоактивного распада пропорциональна наличному числу ядер:
dN / dτ = - λN,
где dN/dτ — количество ядер, распадающихся в единицу времени, т. е. скорость распада; N — число имеющихся в данный момент радиоактивных ядер. Коэффициент пропорциональности К называется постоянно и радиоактивного распада. Она равна доле ядер, распадающихся за единицу времени. Для каждого радиоактивного изотопа λ имеет определенное значение и не зависит от температуры, давления, электрического и магнитного полей, химического состояния радиоактивного изотопа, его концентрации.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 590; Нарушение авторских прав?; Мы поможем в написании вашей работы!