
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Атомов
|
|
|
|
Элементов и электронная структура
Лекция 6. Периодическая система
В главных подгруппах сверху вниз основной характер оксидов увеличивается, а кислотный характер (кроме элементов I – II групп) уменьшается.
Свойства оксидов элементов тоже изменяются: в периоде слева направо усиливается кислотный характер оксидов, а основной характер уменьшается.
Na2+1O Mg+2O Al2+3O3 Si+4O2 P2+5O5 S+6O3 Cl2+7O7
1442443 123 144442444443
основные оксиды; амфотерный оксид; кислотные оксиды
 |
кислотный характер оксидов увеличивается.
1. Периодическая система элементов Д.И.Менделеева.
2. Электронная структура атома и свойства элементов.
1. Периодическая система элементов Д.И.Менделеева
Для каждого атома в принципе возможно неограниченное число отдельных состояний, различающихся по своей энергии. Среди них одно единственное состояние с наименьшей энергией называется нормальным или невозбужденным. Все остальные энергетические состояния с большим запасом энергии называются возбужденными. Для перевода атома из нормального в возбужденное состояние необходимо сообщить ему некоторую энергию — энергию возбуждения. Когда речь идет об электронной структуре атомов, имеют в виду прежде всего их нормальное состояние.
При переходе атома из возбужденного в нормальное состояние полностью восстанавливается структура электронной оболочки. Если строение атомов можно было бы описать классической физикой, отражающей непрерывность изменения свойств, атомы одного и того же химического элемента в нормальном состоянии имели бы различные электронные структуры и утратили свою индивидуальность. При этом исчезло бы различие между элементами и само понятие химического элемента утратило бы свой смысл. Существование химических элементов с их специфическими свойствами связано с квантовыми закономерностями, согласно которым структура электронной оболочки атома в нормальном состоянии однозначно определяется зарядом ядра или порядковым номером элемента в Периодической системе. При заполнении электронных слоев и оболочек атомы подчиняются: 1) условию минимума энергии, согласно которому электроны сначала заселяют вакантные орбитали с минимальной энергией; 2) правилу Гунда — на вырожденных орбиталях заполнение электронами происходит так, чтобы атом имел максимальное число параллельных спинов.
Рассмотрим связь между электронным строением атомов и положением элементов в короткой 8-клеточной Периодической системе. У каждого последующего элемента Периодической системы на один электрон больше по сравнению с предыдущим.
Наиболее прост первый период Системы, состоящий лишь из двух элементов. У водорода единственный электрон заселяет наинизшую энергетическую орбиталь 1 s, а у гелия на этой же орбитали два электрона с антипараллельными спинами. Гелием заканчивается первый период cистемы и исчерпаны все вариации квантовых чисел при n = 1. Таким образом, атом гелия полностью формирует наиболее близкий к ядру К -слой.
Формирование L -слоя (n = 2) начинается с лития, у которого имеется три электрона. Два первых электрона, как у гелия, заполняют К -слой. Третий электрон лития не может находиться в этом слое, так как на l s -орбитали электронных вакансий нет. Помещение третьего электрона на s -орбиталь, максимальная электронная емкость которой равна двум, противоречило бы принципу Паули. У последнего элемента второго периода неона все s - и р -орбитали при n = 2 заполнены.
Третий период (n = 3) начинается с натрия, электронная формула которого 1 s 22 s 22 p 63 s 1 или [Ne]3 s 1. У аргона заполняются полностью все s - и р -оболочки при n = 3. Аргоном заканчивается третий период Периодической системы. Однако не исчерпаны все возможности вариации квантовых чисел при главном квантовом числе, равном трем. При n = 3 существуют пять 3 d -орбиталей (l = 2), каждая из которых вмещает по два электрона. Пока все эти орбитали вакантны, а следующим после аргона элементом является калий — первый представитель четвертого периода Системы.
Хотя в третьем слое остается незаполненной вся d -оболочка (10 вакансий), у калия и кальция начинает заполняться четвертый слой (n = 4). Об этом свидетельствуют спектры и химические свойства этих элементов, являющихся химическими аналогами соответственно натрия и магния. Если у последних наружными являются 3 s -электроны, то у калия и кальция наиболее удалены от ядра периферические электроны 4 s.
Начинай с 21-го элемента скандия заполняется 3 d -оболочка, которая формально принадлежит предыдущему слою при n = 3. Поэтому в четвертом ряду Периодической системы слева направо не наблюдается заметного убывания металлических свойств, так как на внешнем электронном слое (n = 4) имеется всего два электрона 4 s 2. Исключение составляет лишь хром, для которого наблюдается “провал” одного электрона с 4 s 2 на 3 d. Провалы электронов наблюдаются и для других элементов. Они оправданы энергетически, т.е. подчиняются принципу наименьшей энергии, и находят экспериментальное подтверждение при изучении тонкой структуры спектров.
Полностью 3 d -оболочка укомплектована у цинка, у которого на ней все 10 электронов. У галлия, подобно алюминию, появляется один электрон на р -оболочке, точнее на 4 р 1. Четвертый период заканчивается также благородным газом криптоном с полностью заполненной 4 р 6-оболочкой. Между кальцием (4 s 2) и галлием (4 р 1) как бы «вклиниваются» десять элементов от скандия до цинка, для которых характерно заселение электронами 3 d -орбиталей. Эти металлы Sc ® Zn образуют первую десятку элементов вставной декады.
Пятый период аналогичен четвертому. Здесь вторую десятку элементов вставной декады составляют металлы Y ® Cd, для которых свойственно заполнение 4 d -орбиталей. С индия начинается заполнение 5 р -оболочки, которое заканчивается в атоме ксенона. При этом 4 f, 5 d и 5 f остаются совершенно вакантными, а пятый период полностью завершен. Объясняется это тем, что периоды формируются быстрее, чем квантовые слои. Эта закономерность четко прослеживается, начиная с третьего периода.
В шестом периоде после лантана, у которого на оболочке 5 d появляется один электрон, следуют 14 лантаноидов. Для них характерно заполнение в общем 4 f -оболочки. Один электрон на S d -орбитали (как у лантана) сохраняется только у гадолиния (Z = 64) и лютеция (Z = 71). Поскольку у лантаноидов, представителей шестого периода, происходит заполнение глубоколежащего внутреннего (n — 2)-слоя, структура внешнего и второго снаружи слоя совершенно идентична, Это является определяющим в химическом поведении лантаноидов, оно объясняет аномально сильно выраженную аналогию в химических свойствах этих элементов.
Второй электрон на Sd-оболочке появляется только у гафния (Z = 72). А полностью S d -орбитали заполняются у атома ртути. Таким образом, десять металлов от лантана до ртути (без лантаноидов) входят в третью десятку элементов вставной декады. Тогда лантаноиды, у которых происходит заселение 4 f -орбиталей, являются вставкой во вставку, так как они вклиниваются между лантаном и гафнием. У таллия начинает заполняться 6 р -оболочка, которая завершается в атоме радона.
В незаконченном седьмом периоде у франция начинается, а у радия заканчивается заполнение 7 s -оболочки. Атом актиния, как и лантана, начинает заполнение d-оболочки. В случае актиния это будут 6 d -орбитали. Актиноиды (90—103) застраивают 5 f -оболочку. Так как с ростом порядкового номера разница в энергиях соответствующих орбиталей делается все меньше, в атомах актиноидов происходит своеобразное соревнование в заполнении 5 f - и 6 d -орбиталей, энергии которых очень близки.
У 104-го элемента курчатовия, открытого в Дубне под руководством акад. Флерова Г. Н., очередной электрон заселяет 6 d -оболочку, доводя ее до 6 d 2. Поэтому курчатовий является химическим аналогом гафния, что доказано экспериментально. По-видимому, у 105-го элемента (впервые также полученного в лаборатории акад. Флерова в 1969 г.) 6d -оболочка будет состоять из трех электронов, т.е. 105-й элемент должен быть химическим аналогом тантала экатанталом.
Особенности заполнения электронных слоев и оболочек атомов Периодической системы:
1. Номер периода совпадает с максимальным значением главного квантового числа для элементов данного периода, т. е. начало каждого периода совпадает с началом нового электронного слоя.
2. Каждый период начинается с элементов (водорода и щелочных металлов), для которых наружная оболочка состоит из одного электрона ns1. Завершается любой период благородным газом с октетной (кроме гелия) внешней электронной оболочкой ns 2 np 6 при n > 1.
3. У типических элементов и элементов главных подгрупп, непосредственно следующих за типическими по вертикали, заполняются либо внешние ns -оболочки (I и II группы), либо внешние nр -оболочки (III—VIII группы). Первые, для которых характерно заселение ns-оболочек, называются s - элементами, а вторые с заполняющимися nр -оболочками именуются р -элементами. У элементов побочных подгрупп, включая побочную подгруппу VIII группы, происходит заполнение внутренних (n — 1) d -оболочек (если не считаться с отдельными провалами электронов). Они называются d -элементами.
4. Для лантаноидов и актиноидов характерно заполнение глубинных (n — 2)f-оболочек (соответственно 4 f - и 5 f -оболочек). Поэтому лантаноиды и актиноиды относят к f -элементам.
5. Для элементов-аналогов наблюдается одинаковое число электронов на одноименных оболочках при разных значениях главного квантового числа. Поэтому физический смысл Периодического закона заключается в периодическом изменении свойств элементов в результате периодически возобновляющихся сходных электронных оболочек атомов при последовательном возрастании значений главного квантового числа.
Таким образом, с ростом порядкового номера заполнение орбиталей происходит в следующем порядке:
ls<2s<2p<3s<3p<4s»3d<4p<5s»4d<5р<6s»4f»5d<6p<7s»5f» 6d<7p не завершены
В полудлинной 18-клеточной Периодической системеотсутствуют побочные подгруппы, так как элементы вставной декады занимают клетки между s - и р -элементами. Такую систему легко разбить на отдельные секции (рис. 3) по расположению в ней s -, p -, d - и f -элементов. Секция, обозначенная s, содержит по два элемента каждого периода, секция р — по шесть, секция d — по десять и т. д. в соответствии с максимальной электронной емкостью той или иной оболочки. Такое естественное расчленение Периодической системы на отдельные секции еще раз демонстрирует ее неразрывную связьсостроением электронных оболочек атомов химических элементов.
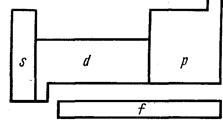
Рисунок 3. Секции полудлинной формы Периодической системы со схемой заполнения s -, р -, d - и f -орбиталей
Однако в полудлинном варианте Периодической системы f -элементы продолжают оставаться за ее пределами. От этого недостатка свободна длиннопериодная 32-клеточная Периодическая система. В ней лантаноиды и актаноиды вставлены между III В и IVB группами d -элементов. В длиннопериодном варианте Системы видно, что f -элементы (лантаноиды и актиноиды) являются вставкой во вставку из d -элементов.
2. Электронная структура атома и свойства элементов
Как было показано, структура электронной оболочки атомов химических элементов изменяется периодически с ростом порядкового номера элемента. Поскольку свойства являются функцией строения электронной оболочки, они должны находиться в периодической зависимости от заряда ядра атомов. И действительно, для самых разнообразных характеристик элементов указанная зависимость выражается периодическими кривыми, имеющими ряд максимумов и минимумов. Даже такие на первый взгляд непериодические свойства, как удельная теплоемкость простых веществ, частоты линий рентгеновского спектра элементов и т. д., при внимательном анализе оказываются периодическими. Объясняется это тем, что периодичность присуща всей электронной оболочке атомов, а не только ее внешним слоям. Рассмотрим кратко наиболее важные периодические свойства элементов.
Одним из важнейших свойств химического элемента, непосредственно связанным со структурой электронной оболочки, является ионизационный потенциал. Последний является мерой работы, необходимой для отрыва наиболее слабо связанного электрона из атома в его нормальном состоянии. Это будет потенциал ионизации первого порядка и который отвечает процессу Э = Э+ + е -. Энергию ионизации можно выражать в любых единицах, имеющих размерность энергии (например, в килокалориях), но чаще всего ее измеряют в электронвольтах. Для многоэлектронных атомов в принципе существует столько энергий ионизации сколько электронов в атомах. От атомов химических элементов можно последовательно оторвать все электроны, сообщив дискретные значения потенциалов I1, I2, I3 и т. д. При этом I1 < I2 < I3… В табл. 1 приведены потенциалы ионизации различных порядков для элементов первых двух периодов Периодической системы. При сравнении величин ионизационных потенциалов разных порядков для атомов одного и того же элемента обращает на себя внимание сравнительная легкость отрыва электронов наружных слоев. Так, для атома лития первый ионизационный потенциал равен 5,39 В, а энергии ионизации второго и третьего порядков соответственно равны 75,62 и 122,42 В. Удаление одиночного электрона наружного слоя 2s1 (I1 = 5,39 В) происходит несравненно легче, чем двух электронов внутреннего слоя (I2 = 75,62 и I3 = 122,42), т. е. I1 «I2 < I3. У азота для отрыва первых пяти электронов второго от ядра слоя (n = 2) требуются лишь десятки электронвольт, а удаление двух электронов внутреннего слоя с главным квантовым числом n = 1 сопровождается затратой энергии в сотни электронвольт. Для элементов второго периода в табл. 1 границы резкого возрастания энергий ионизации обозначены жирной линией.
Таблица 1
Потенциалы ионизации некоторых элементов в В
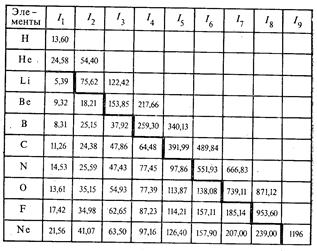
Анализ данных табл. 1 позволяет связать более тонкие изменения энергий ионизации с характером заполнения электронных оболочек. Для элементов второго периода при переходе от лития к неону наблюдается возрастание энергии ионизации. Это объясняется увеличением заряда ядра при постоянстве числа электронных слоев. В то же время возрастание энергий ионизации первого порядка происходит внутри периода неравномерно. Так, например, у бора и кислорода наблюдается заметное уменьшение I1 по сравнению с предшествующими элементами бериллием и азотом. У бериллия внешняя 2 s -оболочка заполнена полностью, а потому трудно оторвать один электрон. У бора один р -электрон менее прочно связан с ядром, чем s-электроны бериллия. Отсюда энергия ионизации первого порядка атома бора меньше, чем у атома бериллия.
Строение атома азота в нормальном состоянии в соответствии с правилом Гунда будет
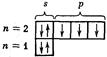
Из схемы видно, что на 2 р -орбиталях имеется по одному электрону. У кислорода четвертый электрон 2 р -оболочки обязательно попадает на одну из занятых р -ячеек. Два электрона одной и той же орбитали сильно отталкиваются, а потому I1 атома кислорода меньше, чем у азота. Таким образом, энергии ионизации отражают дискретность структуры электронных слоев и оболочек атомов химических элементов.
Поскольку ионизационные потенциалы являются функцией строения электронной оболочки атомов, они обнаруживают периодическую зависимость от порядкового номера элементов (рис. 4). Периодическую зависимость можно проследить и в характере изменения энергий ионизации второго, третьего и т. д. порядков. Наименьшими величинами энергий ионизации первого порядка обладают атомы щелочных металлов. Это объясняется сильным экранированием заряда ядра электронными оболочками атомов благородного газа, которые предшествуют внешнему ns 1-электрону атомов щелочных металлов.
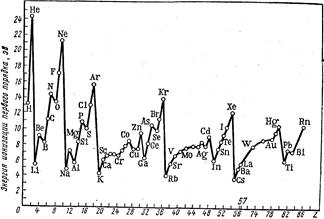
Рисунок 4. Периодическая зависимость ионизационных потенциалов атомов от порядкового номера элемента
Эффект экранирования, заключается в уменьшении воздействиянаданный электрон положительного заряда ядра из-за наличия между ним и ядром других электронов. Экранирование растет с увеличением числа электронных слоев в атомах и уменьшает притяжение внешних электронов к атомному ядру. Экранированию противоположен эффект проникновения, обусловленный тем, что согласно квантовой механике электрон может находиться в любой точке атомного пространства. Поэтому во внутренних областях атома, близких к ядру; вероятность нахождения даже внешних электронов достигает конечной величины. На рисунке 5 приведено радиальное распределение вероятности 3 s -электрона атома натрия, из которого видно проникновение 3 s -электрона во внутренние К,- и L -слои атома. Эффект проникновения увеличивает прочность связи электрона с ядром.

Рисунок 5. Радиальное распределение вероятности нахождения 3 s -электрона в атоме натрия
Эффекты экранирования и проникновения можно рассматривать с единой точки зрения, так как формально они являются способом учета взаимного влияния электронов друг на друга. В отсутствие других электронов согласно уравнению энергия рассматриваемого электрона зависит только от заряда ядра Z и главного квантового числа n. Влияние других электронов на данный электрон уменьшает Z и n: Z эфф и n эфф — эффективный заряд ядра и эффективное главное квантовое число соответственно. При этом экранирование ведет к Z эфф < Z, а эффект проникновения делает n эфф < n. Поэтому первый эффект уменьшает энергию связи данного электрона с ядром, а второй увеличивает. Это происходит потому, что, чем больше Z и чем меньше n, тем ниже лежит энергетический уровень в одноэлектронной системе, тем прочнее связав электрон с ядром.
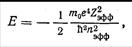
Расчеты показывают сильное уменьшение эффективного заряда ядра для атомов щелочных металлов по сравнению с другими атомами. Так, для атома фтора Z эфф = 5,20 (Z = 9), а для натрия Z эфф = 2,2 при 7 = 11. В табл. 2 приведены значения n эфф для низших s -, р -, d - и f -орбиталей щелочных металлов и металлов подгруппы меди. В скобках приведены значения главного квантового числа n, для которых вычислены соответствующие n эфф, учитывающие эффект проникновения.
Из данных табл. 2 видно, что наибольшим проникающим эффектом обладают s-электроны, меньшим — р -электроны и еще меньшим — d - и f -электроны. Последние (точнее 4 f -электроны) практически не имеют эффекта проникновения.
Таблица 2
Значения nэфф для некоторых металлов
| Элементы Li Na К Pb Cs Сu Ag Аu | Орбитали | ||
| S 1,59(2) 1,63 (3) 1,77 (4) 1,80 (5) 1,87 (6) 1,33 (4) 1,34 (5) 1,21 (6) | р 1,96 (2) 2,12 (3) 2,23 (4) 2,28 (5) 2,33 (6) 1,86 (4) 1,87 (5) 1,72(6) | d 3,00 (3) 2,99 (3) 2,85 (3) 2,77 (4) 2,55 (5) 2,98 (4) 2,98 (5) 2,98 (6) | f 4,00 (4) 4,00 (4) 3,99 (4) 3,99 (4) 3,98 (4) 4,00 (4) 3,99 (4) - |
Кроме того, эффект проникновения более характерен для тяжелых атомов с большим числом электронов во внутренних слоях, сквозь которые и проникает внешний электрон. Наконец, проникновение внешних электронов во внутрь атома исключительно сильно выражено для d -элементов Периодической системы.
Однако с увеличением числа электронных слоев сильно возрастает расстояние внешнего электрона от ядра, что уменьшает энергию ионизации. Например, для щелочных металлов это играет доминирующую роль по сравнению с увеличением эффекта проникновения. Поэтому в направлении сверху вниз для щелочных металлов наблюдается слабое уменьшение (из-за проникновения внешнего электрона) энергий ионизации первого порядка.
Вследствие ярко выраженного эффекта проникновения d -элементов энергии ионизации для металлов вставных декад выше, чем у металлов главных подгрупп. В самих же вставных декадах ионизационные потенциалы сравнительно мало изменяются при переходе от одного элемента к другому. Среди d -элементов сравнительно большими значениями энергий ионизации характеризуются металлы, следующие за лантаноидами. Объясняется это проникновением электронов 6 s -оболочки под двойной “экран” из 5 d - и 4 f -электронов.
Периодически изменяется и сродство к электрону. Под последним понимают энергию, которая выделяется или поглощается при присоединении электрона к нейтральному атому, т. е. энергию процесса Э + е - = Э-. Наибольшим сродством к электрону характеризуются р-элементы VII группы. Наименьшие (и даже отрицательные величины) сродства к электрону имеют атомы с конфигурацией внешних электронов ns 2 и благородные газы. В табл. 3 приведены величины сродства к электрону для некоторых элементов. Сродство к электрону надежно определено далеко не для всех атомов.
Даже для типических неметаллов квантовомеханические расчеты показывают, что сродство их атомов к двум и более электронам всегда отрицательно. Так, электронное сродство второго порядка для атома кислорода равно —7,6 эВ, а для серы —3,5 эВ. Поэтому многозарядные отрицательные ионы типа О2-, S2-, N3- и т. д. не могут существовать ни в свободном состоянии, ни в молекулах, ни в кристаллах.
Таблица 3
Электронное сродство атомов некоторых элементов
| Атом | £, эВ | Атом | Е, эВ | Атом | Е, эВ | Атом | Е, эВ |
| н Не Li Be В | 0,75 0,19 0,82 -0,19 0,33 | С N F Ne | 1,24 0,05 1,47 3,50 -0,57 | Na Mg Al Si P | 0,47 -0,32 0,52 1,46 0,77 | S Cl Ar К Вr | 2,15 3,70 -1,0 0,82 3,51 |
Радиусы атомов и ионов. С точки зрения квантовой механики изолированный атом не имеет строго определенного размера, так как электронная плотность теоретически обращается в нуль лишь на бесконечно большом расстоянии от ядра. В то же время электронное облако практически становится очень размытым уже на отрезке в несколько ангстрем от ядра. Поэтому определять абсолютные размеры атомов невозможно.
Первоначально сложилось представление об эффективных радиусах атомов, проявляющихся в их действиях, т. е. в химических соединениях. Эффективные радиусы определяли из экспериментальных данных по межъядерным расстояниям в молекулах и кристаллах. При этом предполагалось, что атомы представляют собой несжимаемые шары, которые соприкасаются своими поверхностями в соединениях. При определении значения эффективного радиуса из межъядерных расстояний в ковалентных молекулах подразумевали ковалентные радиусы, при вычислении их из данных металлических кристаллов — металлические радиусы. Наконец, эффективные радиусы, найденныеизкристаллов с преимущественно ионной связью назывались ионными радиусами. Металлические радиусы получены делением пополам расстояния между центрами двух смежных атомов в кристаллических решетках металлов. Ковалентные радиусы неметаллов также вычислены как половина межъядерного расстояния в молекулах или кристаллах соответствующих простых веществ. Для одного и того же элемента эффективные радиусы (ковалентный, металлический и ионный) далеко не совпадают между собой. Это свидетельствует о зависимости эффективных радиусов не только от природы атомов, но и характера химической связи, координационного числа и других факторов. Изменение эффективных радиусов атомов носит периодический характер (рис. 6).
Рисунок 6. Зависимость эффективных радиусов атомов от порядкового номера элемента
В периодах по мере роста заряда ядра эффективные радиусы атомов уменьшаются, так как происходит стяжение электронных слоев к ядру (при их постоянстве для данного периода). Наибольшее уменьшение характерно для s - и р -элементов. В больших периодах для d - и f -элементов наблюдается более плавное уменьшение эффективных радиусов, называемое соответственно d - и f -сжатием. Эффективные радиусы атомов благородных газов, которыми заканчиваются периоды Системы, значительно больше эффективных радиусов предшествующих им р -элементов. Значения эффективных радиусов благородных газов получены из межъядерных расстояний в кристаллах этих веществ, существующих при низких температурах. А в кристаллах благородных газов действуют слабые силы Ван-дер-Ваальса в отличие, например, от молекул галогенов, в которых имеются прочные ковалентные связи.
В подгруппах Периодической системы эффективные радиусы атомов в целом увеличиваются из-за роста числа электронных слоев. При этом в подгруппах s - и р -элементов рост эффективных радиусов происходит в большей мере по сравнению с подгруппами из d -элементов. Так, например, ниже приведен рост эффективных радиусов атомов в подгруппах германия и хрома:
Подгруппа р-элементов....... Ge Sn Pb
Эффективные радиусы атомов, Ǻ 1,39 1,58 1,75
Подгруппа d-элементов....... Сr Мо W
Эффективные радиусы атомов, Ǻ 1,27 1,39 1,40
Обращают на себя внимание практически совпадающие значения атомных радиусов для молибдена и вольфрама, хотя эти элементы являются представителями разных периодов Системы. Оказывается, эффективные атомные радиусы d -элементов V и VI периодов данной подгруппы примерно одинаковы. Обусловлено это тем, что увеличение радиусов в результате возрастания числа электронных слоев при переходе от V к VI периоду компенсируется 4 f -сжатием при заполнении f -оболочки у лантаноидов. Поскольку лантаноиды вклиниваются в самом начале d -элементов VI периода, последующие за ними элементы вставной декады характеризуются аномально низкими величинами эффективных атомных радиусов. 4 f -cжатие лантаноидов называется лантаноидной контракцией.
В последнее время (начиная с 1965 г.) в связи с бурным развитием электронно-вычислительной техники получило определенное распространение понятие об орбитальных радиусах атомов. Действительно, за истинный радиус атома условно можно принять геометрическое место точек (относительно ядра) максимума плотности его внешней электронной орбитали. Эти расстояния от ядра до наиболее удаленного от него максимума электронной плотности и представляют собой орбитальные радиусы атомов. Для любого атома может быть только один орбитальный радиус для нормального состояния и сколько угодно значений орбитального радиуса для возбужденных состояний.
Подобно эффективным радиусам орбитальные радиусы атомов также обнаруживают явную периодичность в зависимости от порядкового номера элемента (рис. 7). В пределах каждого периода наибольшим орбитальным радиусом обладает щелочной металл, а наименьшим — атомы благородных газов. В отличие от эффективных радиусов орбитальные радиусы инертных газов хорошо укладываются в общую закономерность уменьшения размеров атомов по мере увеличения заряда ядра внутри данного периода.
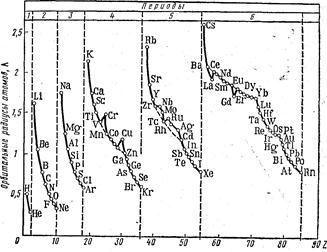
Рисунок 7. Зависимость орбитальных радиусов атомов от порядкового номера элемента
Для металлических элементов характерно удовлетворительное совпадение значений эффективных и орбитальных радиусов, чего нельзя сказать относительно типических неметаллов. В табл. 4 приведены эффективные и орбитальные радиусы некоторых элементов Периодической системы. Из самого понятия орбитального радиуса следует, что он ближе к истинному размеру атома, чем эффективный радиус.
В отличие от эффективного орбитальный радиус является характеристикой нейтрального атома или иона и не зависит от природы химической связи и других факторов. Для предсказания межатомных расстояний в молекулах и кристаллах необходимо знание орбитальных радиусов атомов не только в нормальном, но и в возбужденных состояниях.
Таблица 4
Эффективные и орбитальные радиусы некоторых элементов
| Элемент | rэфф,Ǻ | rорб,Ǻ | Элемент | rэфф,Ǻ | rорб,Ǻ | Элемент | rэфф,Ǻ | rорб,Ǻ |
| Li Na К | 1,55 1,89 2,36 | 1,57 1,80 2,16 | Ti Zr Hf | 1,46 1,60 1,59 | 1,48 1,59 1,48 | s Se | 0,66 1,02 1,16 | 0,45 0,85 0,92 |
Однако даже в настоящее время функционирования мощных компьютеров задача вычисления орбитальных радиусов для возбужденных состояний атомов еще не решена.
По сравнению с возбужденными состояниями легче производится расчет орбитальных радиусов ионов. Для катиона натрия, например, его орбитальный радиус определяется расстоянием от ядра до максимума электронной плотности 2 р -электронов, так как у Na+ отсутствует 3 s -электрон. Теоретический расчет орбитальных радиусов анионов аналогичен расчету соответствующих радиусов нормальных состояний. В таблице 5 приведены орбитальные и эффективные радиусы некоторых ионов и нейтральных атомов.
Таблица 5
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1261; Нарушение авторских прав?; Мы поможем в написании вашей работы!