
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические превращения и химическая кинетика
|
|
|
|
Если имеется смесь молекул двух газов, при столкновениях между ними могут происходить химические реакции. Химические реакции описываются соответствующими уравнениями. Например, реакция между молекулами водорода и хлора приводит к образованию хлористого водорода:
H2 + Cl2 = 2HCl.
Однако приведенное уравнение является лишь брутто-формулой процесса. Обычно реакции протекают довольно сложным путем, который включает целый ряд промежуточных стадий.
Рассмотрением механизма и скорости химических реакций занимается область химической физики, называемая химической кинетикой. Мы здесь ограничимся рассмотрением лишь некоторых существующих здесь основных понятий.
Элементарными реакциями называются такие реакции, которые происходят непосредственно при взаимодействии молекул. Например, для указанного выше процесса химического взаимодействия водорода и хлора таковыми являются:
H + Cl2 = HCl + Cl
Cl + Н2 = HCl + Н
(Есть и другие элементарные реакции, протекающие в данном процессе.) Участвующие в этой схеме атомы водорода и хлора образуются путем начального внешнего инициирования - например, воздействием светового излучения, - в дальнейшем процесс развивается цепным путем. Промежуточные частицы в химических реакциях называются интермедиатами реакций (в данном случае это атомы водорода и хлора).
Элементарная реакция в газовой фазе протекает при столкновении молекул. Поэтому их скорость определяется частотой столкновения. Пусть у нас имеется два сорта молекул А и B, которые при столкновении могут вступать в реакцию и давать продукт С:
А + В = С
Для простоты будем считать, что массы сталкивающихся молекул существенно различаются, m B >> m A, поэтому в можно считать, что 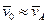 и отсюда частота столкновений одной молекулы А с молекулами В есть
и отсюда частота столкновений одной молекулы А с молекулами В есть
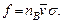
Чтобы определить полное число столкновений в единице объема, это число надо умножить на концентрацию частиц А:
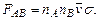
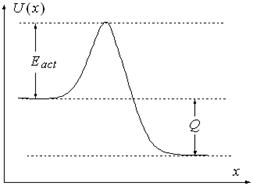
Теперь надо учесть, что реакция может происходить не при всяком столкновении. При сближении молекул им надо преодолеть энергетический барьер, называемый энергией активации, Eact (см. рис. 5.3).
|
| Рис. 5.3. |
Вероятность преодоления барьера определяется фактором Больцмана, т. е. число молекул, преодолевающих барьер, определяется как
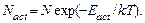
Отметим, что при протекании реакции может выделяться или поглощаться энергия. Величина этой энергии Q (см. рис. 5.3) называется тепловым эффектом реакции.
Для оценки скорости реакции еще надо ввести так называемый стерический фактор, который определяет вероятность «благоприятной» для реакции относительной ориентации частиц при соударении (для частиц из нескольких атомов не при всякой их взаимной ориентации реакция может происходить). Обозначим его за c. Тогда число приводящих к реакции столкновений есть
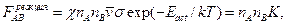 (5.11)
(5.11)
где
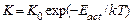 – (5.12)
– (5.12)
константа скорости, а
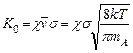 (5.13)
(5.13)
называется предъэкспоненциальным фактором. Его значение порядка 1010 см3/c типично для многих бимолекулярных реакций, в том числе и в жидкости.
Можно написать теперь уравнение, описывающее кинетику процесса:
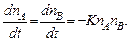 (5.14)
(5.14)
Пусть начальные концентрации n A(0) = n B(0) = n 0. Тогда n A(t) = n B(t) для всякого момента времени t, и решение этого уравнения выглядит как
 (5.15)
(5.15)
Отсюда можно найти концентрации веществ в любой момент времени.
Как видно из (5.11), скорость превращения пропорциональна концентрациям реагирующих частиц. Этот принцип понятен из общих соображений (частоты столкновений молекул пропорциональны их концентрациям). Этот принцип остается справедливым и для реакций, в которых принимает участие большое количество разных молекул, он называется законом действующих масс.
В общем случае реакции могут быть обратимыми, например
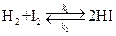
Скорость прямой реакции здесь пропорциональна 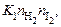 обратной -
обратной -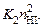 В равновесии скорости прямой и обратной реакции сравниваются. Тогда
В равновесии скорости прямой и обратной реакции сравниваются. Тогда
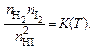 (5.16)
(5.16)
Формально можно написать
H2 + I2 – 2HI=0.
В общем случае всякую реакцию можно записать аналогично:
ν1A1+ ν 2A2 + …= 0,
где А1, А2 и т.д. – обозначения реагентов, n 1, n 2 и т.д. – стехиометрические коэффициенты. В указанном выше примере реакций водорода и иода n 1 = 1, n 2 =1, n 3 = –2. Тогда в равновесии:
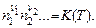 (5.17)
(5.17)
Для выяснения зависимости установления равновесия от внешнего давления перейдем к относительным концентрациям ci:
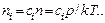
Тогда вместо (5.17) имеем
 (5.18)
(5.18)
Зависимость от давления отсутствует, если сумма n 1 + n 2 + … равна нулю. Если же в реакции полное число частиц меняется, возникает зависимость от давления. Например, для реакции синтеза аммиака
N2 + 3H2 = 2 NH3
из (5.18) имеем
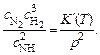 (5.19)
(5.19)
При увеличении давления концентрации азота и водорода по сравнению с концентрацией аммиака должны уменьшаться. Это является отражением общего принципа Ле-Шателье: внешнее воздействие, выводящее систему из равновесия, стимулирует в нем процессы, стремящиеся ослабить результаты этого воздействия.
Глава 6
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 292; Нарушение авторских прав?; Мы поможем в написании вашей работы!