
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принципи каталізу
|
|
|
|

Одна каталізована реакція замінюється кількома проміжними,
з меншим енергетичним ефектом
Суть каталізу полягає у прискоренні досягненнярівноваги хімічної реакції шляхом введення проміжних взаємодій за участю каталізатора:
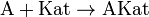
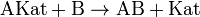
Таким чином, реакція протікає через ряд елементарних стадій, які в сукупності мають нижчуенергію активації, аніж пряма реакція без каталізатору. Навіть незначний виграш у різниці енергій активації за даних умов дозволяє суттєво збільшити швидкість реакції. Ця залежність описується експоненційним рівнянням Арреніуса:
 , де
, де
 — швидкість реакції
— швидкість реакції
 — передекспоненційний множник, який мало залежить від температури
— передекспоненційний множник, який мало залежить від температури
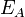 — енергія активацї (Дж/моль)
— енергія активацї (Дж/моль)
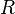 — універсальна газова константа (Дж/(К моль))
— універсальна газова константа (Дж/(К моль))
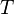 — абсолютна температура (К)
— абсолютна температура (К)
Каталізатор може додаватися в систему окремо або ж утворюватися в ході взаємодії — такий випадок називають автокаталізом. Наприклад, при окисненні щавлевої кислоти розчином солі перманганату утворюються іони Mn2+, які виступають каталізатором реакції:
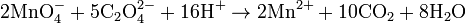
Класифікація
За принципом фазового стану реагентів та каталізаторів розрізняють наступні типи каталізу:
· гомогенний — каталізатор та реагенти знаходяться в одній фазі
газофазний
рідиннофазний
· гетерогенний — каталізатор та реагенти знаходяться в різних фазах
каталіз рідкими каталізаторами, які збільшують швидкість взаємодії між рідинами та газами або між рідинами, що не змішуються
каталіз твердими каталізаторами, які прискорюють взаємодії між рідкими та газоподібнимим речовинами
· мікрогетерогенний — процеси відбуваються у рідкій фазі за участі колоїдних часток металів в якості каталізатора
· ферментативний — процеси у біологічних системах за участі білкових сполук — ферментів.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 943; Нарушение авторских прав?; Мы поможем в написании вашей работы!